BIOTECNOLOGÍA Y PRODUCCIÓN
GUÍAS DE ACTIVIDADES
BIOPROCESOS
02. Inmovilización de levaduras en alginato
03. Fermentación: leveduras libres vs. inmovilizadas
04. La acetificación: fundamentos técnicos
05. El proceso lento de producción de vinagre
06. Cómo montar un fermentador para la acetificación
07. El proceso rápido de producción de vinagre
08. Producción de biomasa de Spirulina (Arthrospira)
ENERGÍA
INDUSTRIA: ENZIMAS, BIOPOLÍMEROS y BIOPLÁSTICOS
11. Microorganismos productores de enzimas
12. Las enzimas en el lavado de la ropa
13. Obtención de un biopolímero (celulosa bacteriana)
16. Plásticos y derivados de caseína
BIORREMEDIACIÓN
17. Biodegradación de detergentes
18. Biodegradación de aceites y grasas
19. Prospección de bacterias degradadoras de gasolina
20. Biocorrosión y anticorrosivos
INTEGRACIÓN DE PROCESOS INDUSTRIALES
21. Extracción de aceite de copra
22. El coco como materia-prima
23. Los rizobios y las leguminosas
PRESENTACIÓN
Galería de imágenes



































Los biofilms se forman en ambientes húmedos cuando las bacterias secretan sustancias poliméricas pegajosas que facilitan su adhesión a una superficie cualquiera. En la naturaleza los biofilms abarcan una variedad de especies bacterianas, hongos, algas, levaduras, protozoos, desperdicios y residuos de corrosión. En presencia de nutrientes y humedad, todo tipo de superficie puede ser colonizada por un biofilm: piedras, metales, implantes médicos, cepillos de dientes, etc.
Cualquier proceso industrial que se desarrolle en medio acuoso puede ser contaminado por biofilms, causando daños importantes como la contaminación del agua, la corrosión y la obstrucción de caños. En el área de la salud humana, más de 500 especies bacterianas fueron identificadas en la placa dental, un biofilm que favorece varias enfermedades periodontales. La persistencia de algunas infecciones en el oído medio (otitis) y en el tracto urinario, por ejemplo, se debería a la protección encontrada por los agentes infecciosos dentro de los biofilms, donde los antibióticos difícilmente llegan.
OBJETIVO
Comparar la formación de biofilms en soportes que recibieron diferentes tratamientos.
MATERIALES
Vasos de plástico o de vidrio de 400 ml, agua de charco, fertilizante para plantas, 3 láminas de plástico PET de 10 x 3 cm, hilo de nylon y aguja, piedritas, esmalte de uñas, vaselina.
PROCEDIMIENTO
1. Preparar las láminas como se indica en el esquema. La piedra evita la fluctuación de la lámina de PET.
2. Pasar vaselina por una de las láminas y esmalte de uñas en la otra. La tercera será el control.
3. Colocar cada lámina en un vaso, previamente rotulado.
4. Llenar los vasos con agua de charco y agregar unas gotas de fertilizante para plantas.
5. Incubar en presencia de luz.
6. Acompañar el desarrollo de los films periódicamente, durante varias semanas.
7. Observar las tres láminas al microscopio estereoscópico y/o al microscopio óptico.

NUESTRO COMENTARIO
Como puede verse en la figura de abajo, se trata de una actividad muy simple que permite introducir el concepto de biofilms sin ninguna dificultad. También permite comparar la eficiencia de diversos tratamientos en la protección de los materiales sumergidos.
Figura. Formación de biofilms. A la izquierda, el experimento, en el centro un detalle del el biofilm formado en la lámina con vaselina y a la drecha un esquema de montaje para un ambiente natural.
¿CÓMO MONTAR UN PROYECTO?
- Investigar el efecto de otras sustancias.
- Investigar el efecto de otros soportes.
- Realizar el experimento en un ambiente acuático natural, como se muestra en el esquema anexo.
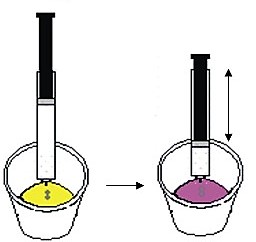
02. INMOVILIZACIÓN DE LEVADURAS EN ALGINATO
Las técnicas de inmovilización se aplican tanto a las células como a los microorganismos y las enzimas. Sus principales ventajas son facilitar la separación del producto y permitir la recuperación del agente biológico. En general, se utilizan con agentes biológicos difíciles de obtener o de precios elevados.
La técnica de inmovilización en alginato de sodio es relativamente simple. Se disuelve el alginato de sodio en un poco de agua caliente, se mezcla bien, y cuando ya está frío se agregan las levaduras. Se deja caer la mezcla final, gota a gota, en una solución de cloruro de calcio. Con el intercambio de iones calcio (del medio) y sodio (del alginato) se forma una matriz de alginato de calcio que retiene las levaduras.
A pesar de tener consistencia sólida, dicha matriz permite la circulación de sustancias, de modo que los agentes biológicos conservan su actividad metabólica. Una vez finalizadas las reacciones químicas esperadas, las bolitas de alginato y la levadura se recuperan fácilmente.
MATERIAL
Balanza, mechero Bunsen, trípode y malla metálica, 3 vasos de precipitados de 100 ml, 1 probeta de 50 ml, 1 espátula, 5 jeringas de 10 ml (sin agujas), 2,5 g de fermento biológico seco instantáneo (levadura), 1 g de alginato de sodio, agua destilada, 1 cuchara plástica, 1 vaso de precipitados con 500 ml de solución de cloruro de calcio 2%, 1 colador, 1 vaso de precipitados con solución de sacarosa (10%), un fermentador construido como se indica en la Guía de Enzimas y Fermentaciones.
PROCEDIMIENTO
Preparación
1. Disolver el alginato de sodio.
3. Mezclar bien las dos soluciones y distribuirlas en las jeringas.
Inmovilización
4. Dejar caer, gota a gota, la mezcla de alginato de sodio y levaduras en la solución de cloruro de calcio.
Agitar suavemente durante el procedimiento.
5. Conservar las esferas de alginato de calcio con las levaduras inmovilizadas en solución de cloruro de calcio 2%. Esperar 24 horas antes de iniciar la primera fermentación.
Primer uso de las levaduras inmovilizadas.
6. Separar las esferas con un colador y luego de lavarlas con agua destilada, colocarlas en el fermentador (solución de sacarosa 10%) para iniciar la fermentación.
Recuperación y acondicionamiento.
7. Concluida la fermentación, colar nuevamente las esferas y lavarlas con agua destilada. Conservar las levaduras inmovilizadas en la heladera, en una solución de cloruro de calcio (2%).

NUESTRO COMENTARIO
Las levaduras inmovilizadas sobreviven bastante tiempo en cloruro de calcio. Aun así, conviene ponerlas a fermentar de vez en cuando. El alginato de sodio debe ser puro y de buena calidad; no obtuvimos buenos resultados con el que se vende en los comercios de productos alimenticios, pero tal vez sea necesario aumentar y ajustar la concentración.
Otros organismos como Arthrospira (Spirulina) también pueden ser inmovilizados siguiendo esta técnica.
BIBLIOGRAFÍA
GODDING, B & SMITH, J. Staffordshire Biotechnology: Secondary Science Curriculum Review. Staffordshire County Council Education Department, 1985.
ENZIMAS Y FERMENTACIONES. Guía 04: Cómo montar un biorreactor para la fermentación alcohólica.
03. FERMENTAÇIÓN: LEVADURAS LIBRES vs. INMOVILIZADAS
Las técnicas de inmovilización se aplican tanto a las células como a los microorganismos y enzimas. Sus principales ventajas son facilitar la separación del producto y permitir la recuperación del agente biológico. Otra ventaja es posibilitar que el manejo de un bioproceso pase de discontinuo a continuo, evitando la pérdida de agentes biológicos difíciles de obtener o de alto coste.
Se trata de una tecnología ventajosa cuando el bioproceso demanda varias reacciones consecutivas, ya que una célula puede realizar directamente varias etapas de un proceso fermentativo como parte de su propio metabolismo. Por esa razón se ha utilizado en la producción industrial de aminoácidos, ácidos orgánicos, etc.
Se aplica a enzimas y a todos los tipos celulares: bacterias, hongos, células vegetales y animales.
OBJETIVO
Comparar la acción fermentativa de las levaduras libres y las levaduras inmovilizadas en alginato de calcio.
MATERIAL
Balanza, 2 fermentadores armados como se indica en la Guía 04: Cómo montar un biorreactor para lafermentación alcohólica (ENZIMAS Y FERMENTACIONES), 1 colador, agua destilada, solución de sacarosa 10 % o jugo (zumo) de frutas con azúcar, 1 g de fermento biológico seco instantáneo, 1 g de fermento seco instantáneo previamente inmovilizado en alginato de calcio como se indica en la Guía anterior.
PROCEDIMIENTO
1. Distribuir en los fermentadores la misma cantidad de sustrato.
2. Inocular el primero con levadura libre.
3. Inocular el segundo con levadura inmovilizada, previamente lavada para retirar el cloruro de calcio.
4. Seguir el proceso fermentativo periódicamente pesando los fermentadores y/o contando el número de burbujas que se forman / minuto.
5. Observar el movimiento vertical de las esferas de alginato de calcio durante la fermentación. Debido a la acumulación de CO2 en la superficie, las esferas resultan más livianas y suben hasta la superficie. Allí, liberan el gas y descienden nuevamente.
6. Una vez finalizada la fermentación, colar y lavar las esferas de levadura inmovilizada en alginato de calcio y guardarlas en la heladera.
7. Analizar e interpretar los resultados.
NUESTRO COMENTARIO
Colocamos 500 ml de jugo de guayaba + 100 ml de solución de azúcar (proporción 1:1 v/v) en cada fermentador. Agregamos 1 g de levaduras libres en el primero y 1 g de levaduras inmovilizadas en el segundo.
Realizamos un seguimiento diario de la fermentación midiendo la masa y el número de burbujas liberado por minuto, como se discute en la Guía corrspondiente (Fermentación alcohólica: cómo monitorear la fermentación). Los resultados se muestran en los gráficos 1 y 2.
La fase exponencial de la fermentación no es observada con las levaduras inmovilizadas, tal vez porque al estar unidas al alginato no se multiplican como cuando están de libres. La reducción de la masa del fermentador también es más lenta con las levaduras inmovilizadas.
Gráfico 1. Número de burbujas por minuto en dos fermentadores, uno de ellos con levaduras libres y el otro con levaduras inmovilizadas, monitoreados una vez al día, durante 19 días.
Gráfico 2. Porcentaje de la masa inicial (Mf/Mi%) de dos fermentadores, uno de ellos con levaduras libres y el otro con levaduras inmovilizadas, monitoreados una vez al día, durante 19 días.
BIBLIOGRAFÍA
ENZIMAS Y FERMENTACIONES Guía 05: Las variables de la fermentación alcohólica.
LARPENT-GOURGAUD, M. & SANGLIER , J. J.Biotechnologies: principes et méthodes. Paris, Doin Editeurs, 1992.
PRIMERA PARTE: ¿CÓMO MEDIR LA ACIDEZ DE UN VINAGRE?
Se titula la concentración de ácido acético presente en el vinagre por titulación ácido-base (volumetría) utilizando fenolftaleína como indicador. En los laboratorios de química, la titulación se realiza con material especializado como pipetas, buretas y soluciones patrón. Tales materiales difícilmente están disponibles por lo tanto simplificamos el procedimiento.
Además de utilizar una solución de NaOH no estandarizada, sustituimos las pipetas por jeringas de 1 ml, las buretas por jeringas de 10 ml y los frascos de Erlenmeyer por vasos plásticos de café.
Cada grupo de alumnos recibe su material, siendo responsable de la limpieza y conservación del mismo. Las jeringas no precisan de agujas; al terminar el trabajo, el material debe ser desarmado, lavado y guardado.
Se agrega a un volumen conocido de vinagre (V= 1 ml), una gota de fenolftaleína, un indicador de pH, incoloro en medio ácido y rosa fucsia en medio básico. A continuación se deja caer lentamente, gota a gota, una solución de hidróxido de sodio (NaOH) de concentración conocida (C NaOH= 0.66%).
Llegará un momento en que todo el ácido acético del vinagre (CH3COOH) será neutralizado por el NaOH de la solución. Dicho momento es fácilmente inidentificable. Cuando agregamos una gota demás de la solución de NaOH, el pH cambia bruscamente y el indicador vira de color. Esto es incluso visible con vinagres de tipo tinto.
El volumen V’ de la solución de NaOH necesario para alcanzar el punto de equivalencia es igual a la concentración del ácido acético en la muestra de vinagre. Por ejemplo, si necesitamos dejar caer 4 ml de una solución de NaOH 0,66% para alcanzar el punto de equivalencia, eso significa que la concentración del ácido acético en el vinagre es de 4%.
Eso, porque en el punto de equivalencia el número de moles de NaOH es igual al número de moles de CH3COOH.
Por consiguiente basta medir el Volumen NaOH necesario para llegar al punto de equivalencia para determinar el valor de la Concentración CH3COOH %.
OBJETIVO
En muchos países, la legislación determina que un producto puede ser llamado vinagre cuando se obtiene de una fermentación y presenta una concentración de ácido acético superior al 4%. En esta práctica, mediremos la concentración de ácido acético del vinagre utilizando un método simplificado de la titulación volumétrica.
MATERIAL
Para cada grupo
Vinagre comercial, solución de fenolftaleína (1%), solución de hidróxido de sodio NaOH (0,66%), 3 vasos pequeños de plástico (50 ml), 1 jeringa de 1 ml, 2 jeringas de 10 ml (ambas sin agujas).
Solución de hidróxido de sodio 0,66%
Pesar 6,6 g de hidróxido de sodio (seco), disolverlo en agua y llevar a un volumen de 1 litro. Conviene preparar con antelación una buena cantidad de solución de hidróxido de sodio, ya que como es higroscópico puede haber variación entre dos soluciones preparadas en diferentes momentos.
Solución de fenolftaleína
Disolver 1 g de fenolftaleína en 50 ml de etanol y agregar 50 ml de agua. Conviene, si bien no es indispensable, utilizar agua destilada.
PROCEDIMIENTO
1. Verter 1 ml de vinagre en el primer vaso.
2. Agregar 1 gota de la solución de fenolftaleína.
3. Tomar con jeringa 10 ml de solución de NaOH 0,66%.
4. Dejar caer la solución de NaOH, gota a gota, moviendo el vaso para mezclar los líquidos hasta observar un cambio de color persistente. El volumen del NaOH agregado indica el porcentaje del ácido acético del vinagre.
5. Repetir el procedimiento en los otros dos vasitos
SEGUNDA PARTE: CÓMO OBTENER VINAGRE FUERTE
La obtención de un caldo con bacterias acéticas (vinagre fuerte), es un paso importante en la producción de vinagres. No es necesario trabajar con especies puras; artesanalmente se utilizan mezclas de diferentes variedades o especies del género Acetobacter.
Existen tres maneras de obtener un inóculo de bacterias acéticas (vinagre fuerte).
La primera es a partir de una botella de vino mal cerrada, con la mitad de su contenido. Con el paso del tiempo el vino se transformará en vinagre. Demora, pero funciona.
La segunda es pedir un poco de vinagre fuerte a algún colega o a un productor de vinagre. Se trata un poco de vinagre sin pasteurizar en el cual puede haber algún fragmento gelatinoso de vinagre-madre. Se prepara el caldo de fermentación mezclando cantidades iguales de vino y vinagre fuerte, y se espera el crecimiento de una capa o película gelatinosa en la superficie del líquido.
La tercera es la más elaborada. Se trata de seguir los conocimientos biológicos sobre la flora microbiana y la sucesión ecológica en la superficie de la uva. A medida que la fruta madura, las levaduras fermentan, transformando el azúcar en alcohol; éste es el sustrato utilizado por las bacterias acéticas para obtener energía y mantener su actividad metabólica.
Se separan del ramo algunas uvas muy maduras, de esas que nadie come. No importa si están un poco pasadas, pero no debe haber crecimiento visible de hongos. Se colocan las uvas en un recipiente que contenga caldo con igual cantidad de vinagre comercial y vino (tinto, blanco o de frutas). Se cierra el recipiente para impedir la entrada de aire, pero dejando bastante aire dentro. Después de algunas semanas, se observará en la superficie una película o capa gelatinosa, llamada madre del vinagre. A partir de ese momento, se amplifica lentamente el cultivo, agregándole vino y monitoreando la acidez como se indica en la primera parte de esta guía.
OBJETIVO
Obtener un cultivo rico en bacterias acéticas, en una cantidad adecuada para nuestras necesidades.
MATERIALES
Recipiente plástico de 500 ml, paño, elásticos, 4-5 uvas bien maduras, vino tinto o blanco, 200 ml de vinagre comercial tinto o blanco, telgopor y palitos para construir una balsa, material para la titulación como se indica en la primera parte de esta guía.
PROCEDIMIENTO
1. Colocar las cortadas y sin semillas en una mezcla de 100 ml de vino y 100 ml de vinagre. Medir la acidez (acidez inicial). Cubrir el vaso con un paño ajustado con un elástico, para evitar la entrada de insectos.
2. Observar, días más tarde, el desprendimiento de un olor ácido acentuado. Esperar unas dos o tres semanas hasta que se formen en la superficie una capa gelatinosa que es la madre del vinagre.
3. Controlando la acidez, que no debe bajar de 3%, agregar semanalmente pequeñas cantidades de vino para ir amplificando el cultivo o vinagre fuerte.
4. Cuando resulte necesario, reemplazar el recipiente por otro mayor, agregando una balsa de sustentación para la zooglea, vinagre madre o madre del vinagre.
NUESTRO COMENTARIO
En la superficie del caldo aparece una película traslúcida que crece hasta formar una capa espesa gelatinosa, la madre del vinagre. Se trata de un polímero de celulosa producido por las bacterias acéticas y que las mantiene en la superficie del líquido en contacto con el aire y el sustrato alcohólico. Aunque tradicionalmente considerada una zooglea, desde el punto de vista microbiológico, la madre del vinagre debe considerarse como un biofilm.
A medida que el tiempo pasa, la madre del vinagre se espesa cada vez más hasta finalmente, hundirse en el líquido. Al poco tiempo, en la superficie se forma una capa nueva.Las capas viejas deben ser retiradas para evitarse su descomposición, lo que daría al vinagre un olor y un sabor desagradables. Se evita este problema colocando una balsa en la superficie del líquido. Uno de los montajes más simples es utilizar mitades de bolitas de telgopor y palitos.
Figura. El vinagre madre
A: balsa de telgopor y palitos; B: zooglea unida a la balsa; C y D: la zooglea, ya liberada de la balsa, que muestra un aspecto gelatinoso, E: visa lateral del caldo y de la zooglea.
¿CÓMO MONTAR UN PROYECTO?
Modificar las condiciones del experimento: variedad de uva, vino tinto o blanco, vinagre tinto o blanco, etc.
BIBLIOGRAFÍA
ZANCANARO JR.O. Vinagres. In: Aquarone E. et al. Biotecnologia Industrial Vol.4. Biotecnologia na produção de alimentos. São Paulo, Editora Edgar Blücher Ltda., 2001.
05. EL PROCESO LENTO DE PRODUCCIÓN DE VINAGRE
El vinagre es una bebida que contiene ácido acético en una concentración de 5-6% y resulta de una fermentación alcohólica seguida de una fermentación acética durante la cual el etanol es oxidado a ácido acético, en una reacción exotérmica, por un agente biológico.
Los procesos de fabricación de vinagre se realizan tanto de manera discontinua, como de manera semicontinua. En el primer caso, al alcanzar las características de acidez deseadas, se retira todo el vinagre producido y se comienza de nuevo. En el segundo, al llegar a una determinada acidez, se retira parte del producto y se agrega una cantidad equivalente de materia prima.
El proceso lento (francés o d’Orléans) es el método más antiguo de fabricación de vinagre. En un barril de roble de 200 litros, se coloca el vino hasta ocupar tres cuartos de la capacidad. En la superficie, en contacto simultáneo con el aire y el vino, se forma una película gelatinosa de Acetobacter, que es llamada la madre del vinagre. Un soporte cuadriculado de madera le impide hundirse en el líquido. La acetificación ocurre en la superficie, con aireación natural.
El proceso es lento, exige espacio y tiene una productividad muy baja. Sin embargo, brinda los mejores vinagres.
OBJETIVO
Producir vinagre mediante el proceso francés (lento).
MATERIALES
Una caja de plástico, 1 balsa de telgopor y línea de nailon, 1 paño de algodón, cinta o elástico de algodón, material para la titulación como se detalla en la Guía 04 (Fermentación acética: cómo titular el ácido acético), vino (graduación alcohólica 12 a 14 grados Gay Lussac (GL) y vinagre fuerte (acidez 7% a 8%), preparado como se indica también en laGuía 04 (Cómo obtener vinagre fuerte) en cantidad suficiente.
PROCEDIMIENTO
Preparar el caldo mezclando vino y vinagre fuerte (proporción 1:3) y medir la acidez inicial (Ai), como se indica en la Guía 04 (Fermentación acética: titulación del ácido acético).
1. Armar el fermentador, colocar la balsa y cerrarlo con un paño, ajustando bien, para evitar la entrada de insectos.
2. Medir semanalmente la acidez hasta que quede estable (Acidez final: Af)
Ver figuras 1 y 2 .
3. Analizar los resultados:
a. Calcular el volumen de etanol en 100 ml de caldo, al inicio de la producción.
b. Calcular cuántos gramos de etanol (Ei) había en 100 ml de caldo, al inicio de la producción, sabiendo que la masa específica de etanol es de 0,78 g/ml.
c. Se calcula que 1 g de etanol puede originar 1,304 g de ácido acético. Justificar esta afirmación, sabiendo que la ecuación de la fermentación acética es:
CH3CH2OH + O2 ------> CH3COOH + H2O
d. Calcular el rendimiento del proceso, que expresa la relación entre la cantidad de ácido acético obtenido y la cantidad de ácido acético esperado. Su valor se calcula mediante la fórmula
R% = 100 (Af – Ai) / (Ei x 1,304)
NUESTRO COMENTARIO
En el proceso francés, la acetificación ocurre en la superficie del caldo, dentro de barriles de roble y con aireación natural. El proceso es lento, exige espacio y tiene una productividad muy baja, pero brinda los mejores vinagres.
El caldo se compone de vino y vinagre fuerte, que es un vinagre con bacterias vivas. Si la cantidad del vinagre fuerte disponible es poca, se puede completar con un poco de vinagre comercial. Una regla debe ser respetada: el caldo debe tener 5-8% de graduación alcohólica y 2-3% de acidez. Concentraciones más altas de etanol son tóxicas para la flora bacteriana que aún no está adaptada al medio, y concentraciones bajas de acidez favorecen las contaminaciones.
Rendimiento y productividad
El rendimiento esperado de la fermentación acética puede ser calculado a partir de la relación estequiométrica según la cual 40 g de etanol pueden ser transformados en 60 g de ácido acético, o sea que 1 g de etanol genera 1,304 g de ácido acético.

C2H5OH + O2 --------> CH3COOH + H2O
40 g 60 g
En la industria, se considera aceptable la transformación de 1 g de etanol en 1 g de ácido acético, correspondiendo a un rendimiento de 76,7%, valor que expresa el porcentaje entre el ácido acético formado y el ácido acético que podría haberse obtenido. En la práctica, calculamos el rendimiento como en el ejemplo siguiente.
Ejemplo: Colocamos en el fermentador 750 ml de vino y 750 ml de una mezcla de vinagre y vinagre fuerte obteniendo una acidez inicial de 3%. Si la graduación alcohólica del vino fuera de 120 GL; podemos decir que introducimos 12 x 750/100 = 90 m de etanol.
Dado que la masa específica del etanol es 0,78 g/ml, este volumen corresponde a 70,2 g de etanol. Siendo el volumen total del fermentador igual a 1.500 ml, calculamos el % de etanol (m/v) inicial según la fórmula:
Ei % = 70,2g x 100 ml / 1.500 ml
Ei % = 4,7%
Cinco semanas después, al medir nuevamente la acidez, encontramos un valor de Af= 7%
Calculamos el rendimiento, aplicando la fórmula:
R% = 100 (Af – Ai) / (Ei x 1,304)
R=100(7-3)/4,7 x1,304
R = 65,3%
La productividad es expresa como la cantidad de ácido acético formado, en gramos/litro x hora, En este caso, la diferencia entre Af y Ai es de 4%, o sea, en 100 ml de caldo se formaron 4 g de ácido acético. Considerando el volumen total de caldo, la cantidad de ácido acético formado es de
4g x 1.500ml / 100ml =60,
que corresponden a una producción de 60g /1,5l= 40g/l
Por consiguiente, la productividad del fermentador a lo largo de 5 semanas, u 840 horas, fue de 0,0476 g/l.h
Problemas posibles
Algunas veces, después de conseguir su valor máximo y estabilizarse, la acidez comienza a disminuir. Esto ocurre porque, al desaparecer el etanol del medio, algunas bacterias acéticas (Gluconobacter) pasan a utilizar el ácido acético como nutriente. Tanto el procesamiento del vinagre como el agregado periódico de vino resuelven el problema.
El exceso de nutrientes y la poca acidez favorecen el crecimiento de Acetobacter xylinum, una especie que produce grandes cantidad de madre del vinagre, llegando a obstruir los ductos del fermentador rápido. También puede ocurrir el crecimiento de la población de bacterias lácticas, que dan al vinagre un olor extraño y bastante desagradable. No tiene solución; se tira todo a la basura y se comienza nuevamente.
Figura 1: Variación de la acidez a lo largo del tiempo (vinagre de vino)
¿CÓMO MONTAR UN PROYECTO?
Una vez estabilizado el fermentador, tres caminos son posibles:
- Adicionar vino al fermentador, esperando un aumento de la producción.
- Procesar, embotellar y pasteurizar el vinagre formado en el fermentador, representando un sistema de producción discontinua, en batch.
- Retirar parte del vinagre (no más del 10%) y agregar en el fermentador una cantidad equivalente de vino, representando un proceso de producción semicontinuo. Llega un momento que la zooglea se espesa demasiado, y debe ser retirada.
BIBLIOGRAFÍA
ZANCANARO JR., O. Vinagres. In: Aquarone, E. et al. Biotecnologia Industrial Vol 4. Biotecnologia na produção de alimentos. São Paulo, Editora Edgar Blücher Ltda., 2001.
06. COMO MONTAR UN GENERADOR PARA LA ACETIFICACIÓN
El vinagre es una bebida que contiene ácido acético en una concentración de 5-6% y resulta de una fermentación alcohólica seguida de una fermentación acética durante la cual el etanol es oxidado a ácido acético, en una reacción exotérmica, por un agente biológico.
Los procesos de fabricación de vinagre se realizan tanto de manera discontinua (proceso lento), como de manera semicontinua (proceso rápido).
En el primer caso, al alcanzar las características de acidez deseadas, se retira todo el vinagre producido y se comienza de nuevo. En el segundo, al llegar a una determinada acidez, se retira parte del vinagre y se agrega más vino al generador. Los procesos contínuos se utilizan industrialmente en otro tipo de acetificadores.
En el proceso rápido (Schuetzenbach o alemán), el generador o fermentador es un recipiente de 100 a 100.000 litros de capacidad relleno con virutas u otro material que tiene una superficie de contacto grande sobre la cual se fijan las bacterias acéticas.
El vino circula repetidas veces en el generador en cuanto se inyecta aire en el sentido contrario. El calor no se disipa tan fácilmente como en el método tradicional, y es necesario, entonces un método de enfriamiento, estableciéndose un gradiente de temperatura que impulsa la circulación del aire (figura de al lado). En relación con el proceso lento, la productividad es mayor, pero la calidad del vinagre es inferior.
OBJETIVO
Montar un generador para la producción de vinagre (proceso rápido)
MATERIALES
Botellas plásticas, algodón, tijeras para cortar las botellas, 1 clavo para agujerearlas, manguera de acuario, manguera de látex, bomba de acuario, aguja de inyección, fósforos.
PROCEDIMIENTO
En el proceso rápido (Schuetzenbach o alemán) el caldo y el aire circulan sobre las bacterias acética fijas a un soporte, condiciones que pueden ser obtenidas en el laboratorio didáctico con materiales simples y de bajo costo. Para construir el generador utilizaremos botellas plásticas y una bomba de acuário que inyecte aire por la manguera que conecta la parte inferior a la parte superior del fermentador, asegurando el suministro de oxígeno y la circulación del líquido.
PROCEDIMENTO
- Conectar el sistema de circulación de aire (bomba de acuário)
- Mantener el generador en observación durante varios días, verificando la circulación de aire y líquido.
NUESTRO COMENTARIO
Dos problemas se observan con cierta frecuencia. Uno de ellos surge cuando la bomba de acuario es colocada a una altura menor que el líquido presente en la parte inferior del fermentador. En un caso de corte de energía, el líquido entra en la bomba y la inutiliza. El segundo, es el reflujo de aire en dirección al fermentador, porque el líquido deja de circular y la falta de nutrientes es perjudicial para las bacterias acéticas que están en las virutas en el compartimento superior.
Para evitar el reflujo se deja un pedazo de manguera bastante largo entre la salida del fermentador y la aguja de inyección. Por tanto, si hubiera reflujo, se debe reestablecer rápidamente la circulación. Un método simple de hacerlo consiste en apretar la manguera de látex antes del lugar donde está colocada la aguja hasta la llegada del líquido y soltar.
Una vez construido el generador o fermentador y contando con un volumen razonable de vinagre fuerte (Guías 04 y 06) el desafío consiste en colocar en funcionamiento un generador que permita reproducir las condiciones características del proceso rápido de producción de vinagre.
OBJETIVO
Producir vinagre mediante el proceso rápido.
MATERIALES
- Material para titulación (Guía 04)
- Vinagre fuerte preparado como se indica en la Guía 04.
- Generador construido como se indica en la Guía 06.
- Vinagre comercial y virutas de madera, lavadas y hervidas.
PROCEDIMIENTO
1. Inoculación de las virutas de madera
Sumergir las virutas en una mezcla de vinagre fuerte (acidez 7%) y vino en una proporción 3:1. Una parte del vinagre fuerte puede ser sustituido por vinagre comercial. Después de 2 a 4 semanas, se observa una película fina y brillante sobre la madera, indicando la fijación de las bacterias al soporte.
2. Entrada en ritmo de producción
a. Montar el fermentador para verificar su funcionamiento como se indica en la Guía 06.
b. Desmontar el fermentador. Colocar el caldo (vinagre fuerte y vino, proporción 3:1) en la botella y las virutas inoculadas en la botella 2. Armar nuevamente el fermentador e iniciar la circulación del caldo hasta observar, después de 2 o 3 días, que la botella 2 se empaña levemente. El fermentador estará cerca de entrar en ritmo de producción.
c. Monitorear la acidez del caldo como se indica en la Guía 04 y, cuando sea suficientemente alta (7 – 10%), retirar una parte del caldo y agregar un volumen equivalente de vino.
d. En ningún momento del proceso, al graduación alcohólica debe ser inferior a 5-8% ni la acidez menor a 4%. El vinagre producido puede ser filtrado, embotellado y pasteurizado (65ºC, 5 minutos).
NUESTRO COMENTARIO
Montamos un sistema simple en el cual el vino circula repetidas veces sobre un soporte de (virutas de madera) donde se adhieren las bacterias acéticas. El monitoreo de la acetificación mostró que la acidez diminuye cuando se retira vinagre y se agrega vino, lo que puede verificarse en el gráfico de abajo. Los valores registrados en los días 5, 8, 11 y 15 corresponden a las mediciones tomadas antes y después de retirar 500 ml de vinagre y colocar 500 ml de vino.
Gráfico. Acidez del vinagre a lo largo de la acetificación (Proceso rápido)
¿CÓMO MONTAR UN PROYECTO?
- Sustituir las virutas de madera por otros materiales: telgopor, bagazo de caña de azúcar, de uva o de manzana, cerámica, piedras, etc.
- Comparar la producción de dos fermentadores, considerando cuanto vinagre al 4% se consigue a partir del volumen de vinagre fuerte retirado por semana.
- Comparar la productividad de dos fermentadores, considerando el valor gramos/litro x hora.
BIBLIOGRAFÍA
ZANCANARO JR., O. Vinagres. In: Aquarone, E. et al. Biotecnologia Industrial Vol 4. Biotecnologia na produção de alimentos. São Paulo, Editora Edgar Blücher Ltda., 2001.
08. PRODUCCIÓN DE BIOMASA DE Spirulina (Arthrospira)
OBJETIVO
Producir biomasa de microalgas, cultivando una cianobactéria (Arthrospira) en un biorreactor.
Observación: Arthrospira figura en los productos comerciales como Spirulina.
MATERIAL
Fermentación: Inóculo de Arthrospira, fermentador, medio de cultivo, termómetro, medidor o papel indicador de pH, probetas, pipetas, microscopio, láminas y lamínulas.
Medidas de turbidez: espectrofotómetro (570 nm) o medidor de concentración, pipetas graduadas.
Obtención de masa seca (mg): bomba de vacío, Kitasato, embudo de Buchner, papel de filtro, placa de Petri, horno o estufa, balanza.
Medio de cultivo: Zarrouk (adaptado) para el cultivo de Arthrospira (Spirulina)
Reactivos
Água Destilada; K2HPO4 = 0,5 g/l; NaNO3 = 2,5 g/l; K2SO4 = 1,0 g/l; NaCl = 1,0 g /l; CaCl2 = 0,04 g/l; MgSO4 . 7H2O = 0,2 g/l; EDTA = 0,08 g/l; FeSO4 . 7 H2O = 0,01 g/l; 2 gotas de Ouro Verde ou de Biofértil; NaHCO3 = 16,8 g/l.
Preparación del medio de Zarrouk
1. Avolumar 750 ml de agua destilada;
2. Pesar 0,5g de K2HPO4, 2,5g NaNO3, 1,0g K2SO4, 1,0g NaCl, 0,2g MgSO4.7H2O, 0,4g CaCl2, 0,8 g EDTA, 0,1g FeSO4 . 7 H2O, 16,8 g de NaHCO3 (este será adicionado por último);
3. Con el auxilio de un agitador magnético adicionar UNO POR UNO los reactivos K2HPO4, NaNO3, K2SO4, NaCl, MgSO4.7H2O a 750ml de agua destilada. Atención, mezclar bien y aguardar hasta que un reactivo se disuelva antes de agregar el siguiente; cuidado con el K2HPO4 y el MgSO4.7H2O (há risco de precipitação).
4. Preparar una solución-madre de CaCl2 (0,4g – 100ml), adicionar una alícuota de 10 ml a ls solución anterior.
5. Preparar una solución-madre de EDTA (0,8g – 100ml), adicionar una alícuota de 10 ml a ls solución anterior.
6. Preparar una solución-madre de FeSO4 (0,1g – 100ml), adicionar una alícuota de 10 ml a ls solución anterior.
7. Adicionar 2 gotas de Ouro Verde ou de Biofértil;
8. Finalmente, adicionar los 16,8g de NaHCO3 y, si fuera necesario, ajustar el pH con una solución de NaOH 0,1N.
9. Completar la solução a 1 litro y esterilizarla.
PROCEDIMIENTO
- Diseñar el biorreactor. Cuál es volumen ideal para esta actividad?
- Preparación del medio y determinación de la condiciones de cultivo de Arthrospira
- Montaje del biorreactor e inicio del cultivo de Arthrospira. Acompañar semanalmente el proceso, manteniendo el pH entre 10 e 11 y verificando microscopicamente la pureza del cultivo.
- Monitoreamiento del crecimiento populacional. Extraer semanalmente una alícuota del cultivo y analizarla en el turbidímetro o en el espectrofotómetro. Eventualmente utilizar un medidor de concentración casero: medir el volumen del cultivo necesario para dejar de observar la luz y anotar ese valor en una tabla.
5. Separación de la masa seca, cuando la concentración se mantiene estacionaria.
- Separar la masa de Arthrospira por filtración al vacío y colocar a secar en la estufa.
b. Cuanta masa seca se ha obtenido?
Las imágenes muestran la etapa de filtración del cultivo por Gabriel Politzer Couto, Guilherme Fagundes Pagotto e Luiza Vetorazzo Amaral, alumnos del Segundo año del Curso Técnico de Biotecnología (Nivel Medio), trabajp presentado en la SNCT 2009.
El crecimiento del cultivo fué acompanhado por espectrofotometría a 570nm.
NUESTRO COMENTARIO
La mayor dificultad está en la preparación del medio.
El mejor método para evaluar el crecimiento del cultivo de Arthrospira és la espectrofotometría. En el laboratorio didáctico con un espectrofotómetro y varios alumnos trabajando al mismo tiempo, puede producirse un embotellamiento con la consabida pérdida de tiempo. En función de esa limitación utilizamos en las aulas prácticas métodos más simples, disponibles para todos. Acompañamos el crecimiento de los cultivos con medidores caseros como el de la Global Learning and Observations to Benefit the Environment (GLOBE), que adaptamos como a seguir.
Se fija el disco de base con plástico transparente y elástico en la base de un tubo opaco de PVC de 40 cm. Este es colocado sobre una fuente difusa de luz.
Se adiciona lentamente el cultivo con una pipeta graduada. El volumen necesario para dejar de observar el diseño del disco de base puede ser considerado como una estimativa de la densidad populacional. Los valores obtenidos a lo largo del tiempo muestran el crecimiento de Arthrospira.
Figura: el modelo de la GLOBE y nuestra adaptación.
BIBLIOGRAFÍA
LOURENÇO S.O. Cultivo de microalgas marinhas: Princípios e aplicações. São Carlos, RiMa Editora, 2006
NOSSO AGRADECIMENTO Ao Dr. Sergio de Oliveira Lourenço que nos forneceu o inóculo de Arthrospira (Spirulina)
En ambientes confinados como pantanos o sepulcros, el gas formado genera algunos fenómenos inquietantes de combustión espontánea, como las luces de cementerio. Pero en las condiciones más controladas de un relleno sanitario o de un biorreactor (biodigestor), el gas acumulado podrá ser utilizado como combustible.
Aunque el proceso no sea siempre económico, una visión integrada permite la utilización de otros subproductos formados, abriendo nuevas perspectivas para una vieja biotecnología.
OBJETIVO: producir biogás
MATERIAL
Botellas plásticas, conexiones, tapones, baño a 55 grados Celsius, basura doméstica o artificial, agua, Ca(OH)2, NaOH, papel pH, detergente, vela, fósforos.
Composición de la basura sintética (OECD): Diluir en 1 litro de agua: 160 mg de peptona, 30 mg de urea, 110 mg de extracto de carne, 7 mg de cloruro de sodio, 4 mg de cloruro de calcio (CaCl2.2H2O), 2 mg de sulfato de magnesio (Mg2SO4.7H20), 28 mg de fosfato ácido de potasio (K2HPO4). Se puede adicionar acetato de sodio 1% (masa/volumen).
PROCEDIMENTO
1. En una botella plástica, mezclar 500 ml de basura doméstica (porotos o restos de alimentos + humus de lombrices o lodo + basura sintética) y agua en igual proporción.
2. Agregar 1 g de glucosa.
3. Medir el pH; si fuera necesario corregir el pH a 7,6 con NaOH.
4. Montar el experimento intercalando una botella con Ca(OH)2, como en el esquema.
5. Mantener la botella con los residuos orgánicos a 55 grados Celsius.
6. Pasados 14 días, verificar la presencia de biogás. ¿Cómo?
NUESTRO COMENTARIO
Encontramos algunas dificultades. En uno de los primeros testes, la materia orgánica taponó la manguera de salida de gas originando una explosión que ensució hasta el techo del laboratorio. Recomendamos no llenar la botella a más de la mitad.
Em otra ocasión, la reacción se detuvo. ¿Problemas de pH? Probablemente.
El gas liberado puede ser identificado por combustión. Cerramos debajo del agua la botella con el gas y la llevamos hasta una cuba con agua y unas gotas de detergente. La sumergimos y abrimos lentamente dejando escapar lentamente el gas y acercando una vela prendida a alas burbujas formadas en la superficie.
La altura e intensidad de la llama confirmaran la presencia de un gas combustible (biogás) donde Una botella cerrada con el gas. ¡Todo cuidado es poco!
El biodiesel es un combustible compuesto por ésteres (etílicos o metílicos) producidos en una reacción química de transesterificación (Figura 1). Esta ocurre entre aceites vegetales y alcohol (etanol o metanol), en presencia de un catalizador inorgánico o enzimático (lipasas). Deja como subproducto glicerol (5 a 10% del producto bruto), que es aprovechado por algunas industrias (de alimentos, cosmética, de medicamentos).
Figura 1: La reacción de transesterificación de triacilgliceroles (triglicéridos), donde R representa la cadena de carbono de los ácidos grasos y R, la cadena de carbono del alcohol.

El biodiesel representa entre el 88 y 95% de la energía del diesel, pero cuando se mezcla con el diesel convencional (B1 con 1% de biodiesel a B20 con 20% de biodiesel) aumenta la calidad del combustible, disminuyendo la emisión de partículas contaminantes y gases tóxicos en la atmósfera.
La producción de biodiesel está localizada principalmente en la Unión Europea (60%) y, en menor grado, en los Estados Unidos, China, Indonesia y Malasia. La materia prima es variada: soja en los estados Unidos, canola en la Unión Europea y en Canadá, soja y girasol en Argentina, dendé en Asia. En Brasil, se ha experimentado con soja, papaya, babasú, dendé, girasol, maíz, cacahuete (maní), jatrofa, etc.
OBJETIVO
Preparar biodiesel vía una reacción química de transesterificación.
MATERIALES
Balanza, varilla de vidrio, agua destilada, erlenmeyer, pipeta de 1 ml, pipeta de 10 ml, peras adecuadas, probeta de 100 ml, aceite de soja, 15 ml de metanol, 1 ml de una solución de KOH 9M, embudo de decantación, soporte universal, argolla, nueces, cuchara, mechero Bunsen, vaso de precipitados.
SEGURIDAD: Utilizar chaleco y gafas de seguridad. El metanol es inflamable y venenoso. Debe ser agregado en campana de aire. El hidróxido de potasio es corrosivo. El exceso debe ser neutralizado con ácido clorhídrico 3M antes de ser descartado por la rejilla, y se debe dejar correr mucha agua.
PROCEDIMIENTO
PRIMERA PARTE: Preparación de biodiesel
1. Colocar en un erlenmeyer 100 ml de aceite vegetal.
2. Adicionar, cuidadosamente, 15 ml de metanol.
3. Agregar lentamente 1 ml de solución de KOH 9M.
4. Agitar la mezcla por 10 minutos.
5. Colocar en el embudo y esperar que decante.
6. Retirar la capa inferior.
7. Lavar la capa superior con 10 ml de agua destilada y dejar decantar nuevamente. La capa superior es el biodiesel.
8. Medir la cantidad de biodiesel obtenida y calcular el rendimiento relativo a la cantidad de aceite vegetal utilizada.
SEGUNDA PARTE: Test de combustión
Este test es realizado colocando 2 ml de combustible en una cuchara sujeta a un soporte universal y calentando con el mechero Bunsen hasta inflamar. La diferencia observada entre la combustión del aceite vegetal utilizado como materia prima y del producto obtenido en la reacción de transesterificación sugiere que realmente se obtuvo biodiesel.
RESULTADOS
Calcular el rendimiento del proceso, sabiendo que 1.200 kg de aceite vegetal producen 1.100 kg de biodiesel crudo.
NUESTRO COMENTARIO
La primera parte del protocolo es una traducción del texto citado en la Bibliografía. La segunda parte es un test adicional agregado por nosotros para confirmar la presencia de un combustible más eficiente que el aceite original. La preparación de Biodiesel fue uno de los temas presentados en la Semana Nacional de la Ciencia y Tecnología (2005) por nuestra clase de tercera serie de Biotecnología del Instituto de Tecnología ORT.
En esa ocasión nuestros alumnos prepararon biodiesel a partir del aceite usado para freír papas, cedido gentilmente por la concesionaria del comedor (Figuras 2 y 3).
Se obtuvieron 95 ml de biodiesel (masa = 76,5 g) a partir de 100 ml de aceite vegetal (masa = 89,3 g), lo que significa un rendimiento del 85,67%. De acuerdo con la bibliografía citada, 1.200 kg de aceite vegetal producen 1.100 kg de biodiesel crudo, de modo que el rendimiento esperado era del 91,7%.
A pesar de ser inferior, los alumnos consideraron el rendimiento del experimento como muy satisfactorio.
En el test de combustión, el producto se mostró inflamable, indicando que el material es realmente un combustible. La llama obtenida como producto era visiblemente diferente de la que se obtenía con el aceite.
¿CÓMO MONTAR UN PROYECTO?
Debido a los cuidados de seguridad requeridos, se debe valorar muy bien las condiciones de trabajo y el nivel de los alumnos antes de realizar cualquier proyecto.
Figura 2. Aceite de cocina usado y biodiesel obtenido.
Figura 3. Algunos momentos de la preparación de biodiesel (SNCT, 2005). De izquierda a derecha: Separación de las capas; primera y segunda decantación; test de combustión
BIBLIOGRAFÍA
WMRC. GREEN CHEMISTRY LESSONS: Biodiesel – Using renewable resources.
11. MICROORGANISMOS PRODUCTORES DE ENZIMAS
Los microorganismos constituyen un grupo muy diversificado y, todavía poco conocido. Existen aún muchas expectativas en relación con la búsqueda de líneas microbianas para la industria, siendo las fuentes más frecuentes el suelo y el lodo de los lagos y ríos. Un gramo de suelo puede contener hasta 10 billones de microorganismos.
El método clásico de aislamiento de microorganismos involucra la selección en diversos medios de enriquecimiento selectivos, con el objetivo de encontrar líneas productoras de enzimas, metabolitos diversos, antibióticos, etc. Actualmente, los avances en el área de la genómica contribuyen a ampliar nuestro conocimiento sobre las comunidades microbianas del ambiente.
Microorganismos industriales pueden ser comprados como líneas puras, genéticamente estables y aptas para el cultivo en gran escala, en Bancos y Colecciones de cultivos.
PRIMERA PARTE: PRODUCTORES DE AMILASAS
OBJETIVO
Identificar microorganismos productores de amilasas, en un ambiente natural.
MATERIALES
1 espátula, 1 tubo de dilución con 5 ml de solución salina estéril o con agua destilada, 1 placa con medio agar-almidón , 1 hisopo, solución de Lugol, 1 pipeta, formol, cinta adhesiva.
PROCEDIMIENTO
1. Tomar una punta de espátula de tierra y transferirla a un tubo de dilución. Mezclar bien.
2. Mojar un hisopo en la suspensión de tierra y distribuir el líquido en la superficie del agar nutritivo, formando un tapete.
3. Cerrar la placa con un pedacito de cinta adhesiva.
4. Incubar a temperatura ambiente hasta visualizar el crecimiento microbiano.
Dado que en esta etapa es prácticamente imposible identificar la presencia o ausencia de patógenos, se recomienda antes de proceder al próximo punto invertir la placa, colocar unas gotas de formol en la tapa y dejar por 24 horas antes de abrir la placa. El aislamiento de líneas solo puede ser realizado por personas entrenadas, en laboratorios adecuados (Trabajar en condiciones seguras).
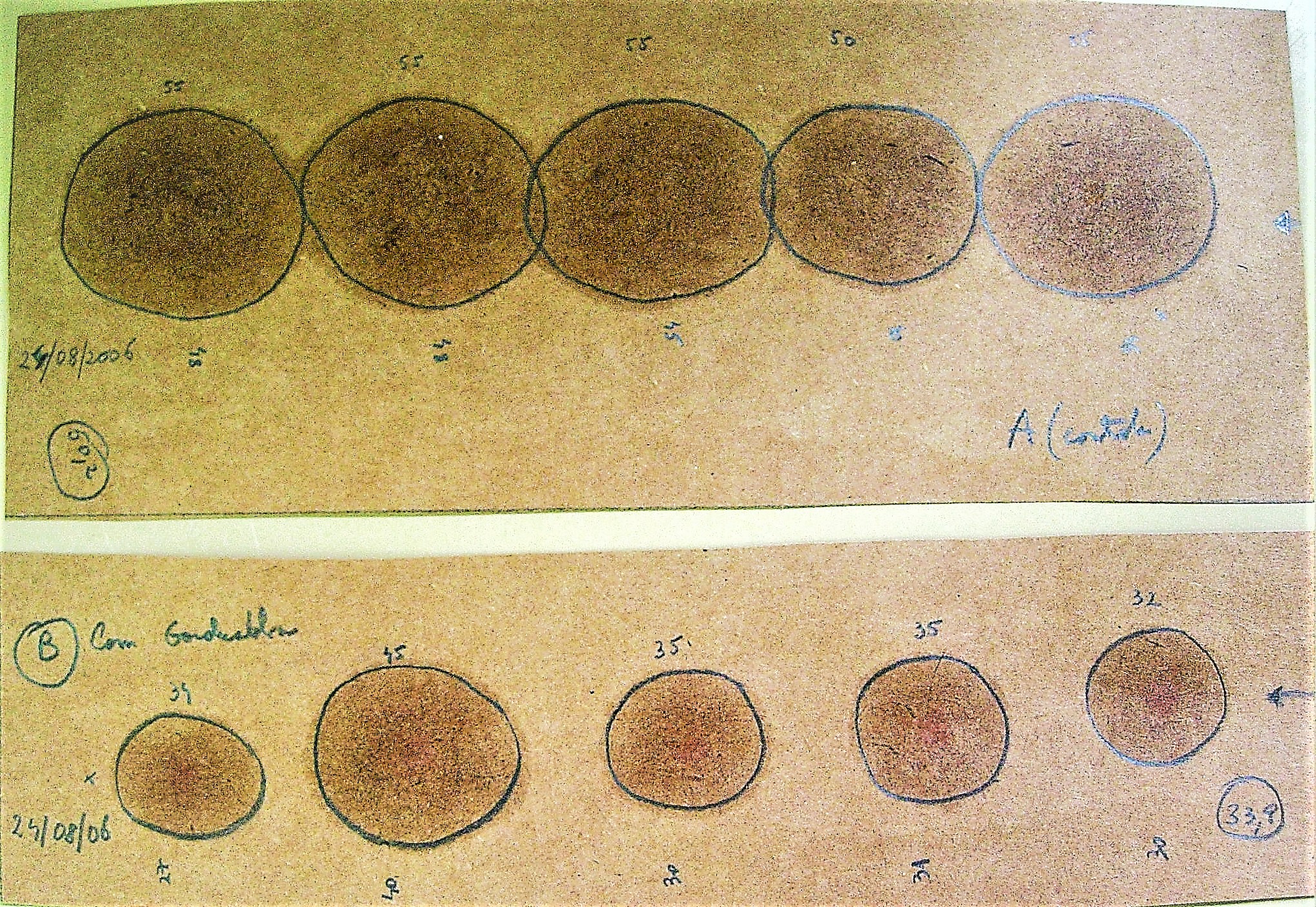
5. Abrir la placa y colocar la solución de Lugol en la superficie del medio. En el lugar donde crecen microorganismos productores de amilasas se formará un halo incoloro, en el lugar donde el almidón no fue digerido el agar presentará una coloración azul característica.
NUESTRO COMENTARIO
Esta actividad tiene que desarrollarse en campo, dando a los alumnos la posibilidad de analizar las características del ambiente, antes de escoger el lugar de donde será tomada la muestra.
Figura: Placa control y placa con microorganismos productores de amilasas. En la primera, la coloración azul es visible y en la segunda, vista de arriba y vista de lado, la ausencia de coloración alrededor de los microorganismos indica la presencia de amilasas. Test con microorganismos provenientes del NEDEA (Núcleo Experimental de Estudos Ambientais, Petrópolis, RJ)
¿CÓMO MONTAR UN PROYECTO?
- Investigar el uso de amilasas en la industria.
- Utilizando esta técnica, estudiar la presencia de microorganismos productos de amilasas en diversos ambientes.
SEGUNDA PARTE: PRODUCTORES DE PROTEASAS
OBJETIVO
Identificar microorganismos productores de proteasas, en un ambiente natural.
MATERIALES
1 espátula, 1 tubo de dilución con 5 ml de solución salina estéril o con agua destilada, 1 placa con medio de agar-leche, 1 hisopo, 1 pipeta, formol, cinta adhesiva.
PROCEDIMIENTO
1. Tomar una punta de espátula de tierra y transferirla al tubo de dilución. Mezclar bien.
2. Mojar el hisopo en la suspensión de tierra y distribuir el líquido en la superficie del agar nutritivo, formando un tapete .
3. Cerrar la placa con un trozo de cinta adhesiva. Las placas no deben abrirse a menos de contar con personal entrenado y condiciones de laboratorio adecuadas, porque no es posible asegurar la ausencia de patógenos (Trabajar en condiciones seguras).
4. Incubar a temperatura ambiente hasta observar crecimiento microbiano.
5. En el lugar donde crecen los microorganismos productores de proteasas se observará un halo incoloro, en el lugar donde la proteína no fue digerida el agar permanecerá blanco opaco.
NUESTRO COMENTARIO
Esta actividad ha sido desarrollada en campo, dando a los alumnos la posibilidad de analizar las características del ambiente, antes de elegir el lugar de donde será tomada la muestra.
La Figura muestra una placa con medio de agar-leche sembrada con microorganismos del NEDEA (Núcleo Experimental de Educação Ambiental, Petrópolis, RJ). La producción de proteasas es evidenciada por la presencia de un halo transparente alrededor de las colonias.
¿CÓMO MONTAR UN PROYECTO?
- Investigar el uso de proteasas en la industria.
- Usando esta técnica, analizar la presencia de microorganismos productores de proteasas en diversos ambientes.
TERCERA PARTE: PRODUCTORES DE CELULASES
La selección de microorganismos productores de celulasas puede realizarse siguiendo un procedimiento análogo al descrito en la primera parte de esta guía para los productores de amilasas.
El medio adecuado es agar-carboximetilcelulosa y los halos alrededor de las colonias productoras de celulasas pueden ser evidenciados con rojo-Congo (cuidado, es tóxico) o con iodo de Gram.
QUARTA PARTE: COMPLEMENTOS TÉCNICOS
MEDIO DE AGAR-ALMIDÓN
Preparación de una goma de almidón al 1%
1. Diluir 1 g de almidón en 10 ml de agua fría.
2. Volcarlo en 90 ml de agua hirviendo.
3. Mezclar y dejar hirviendo durante 3 minutos.
4. Enfriar.
Preparación del medio de cultivo agar-almidón (100ml)
Este medio es también utilizado en el cultivo de hongos.
Dependiendo del operador, 100 ml de medio permiten preparar entre 5 y 8 placas de Petri de 9 cm de diámetro.
1. Preparar una suspensión de 1,3 g de agar en 90 mL de medio nutriente (caldo de carne). Calentar hasta disolver el agar.
2. Agregar 10 mL de goma de amido (1%), preparada como indicado anteriormente. Mezclar bien.
3. Esterilizar. Deijar enfriar hasta aproximadamente 60 grados Celsius, antes de distribuir el medio en las placas de Petri previamente esterilizadas.
MEDIO DE METILCELULOSA
Disolver 0,5 g de Carboxi-metil-celulosa y 2 g de agar en 200 ml de agua destilada y calentar hasta que el medio quede translúcido. Esterilizar y distribuir en placas de Petri.
MEDIO DE AGAR-LECHE
Preparación (100 mL).
Dependiendo del operador, 100 ml de medio permiten preparar entre 5 y 8 placas de Petri de 9 cm de diámetro.
1. Disolver 2 g de leche en polvo desnatada en 10 mL de agua destilada.
2. Preparar una suspensión de 1,3 g de gar en 90 mL de medio nutriente (caldo de carne). Calentar hasta que el agar se disuelva.
3. Esterilizar en recipientes separados la leche y el medio de carne. É inútil mezclarlos antes de esterilizar. El desastre es seguro porque la leche coagula.
4. Enfriar a unos 60 graus Celsius, aproximadamente.
5. Mezclar la leche y el medio de carne.
6. Distribuir en condiciones asépticas en placas de Petri previamente esterilizadas.
REAGENTE DE LUGOL (Solução de iodo-ioduro de potasio)
Conservar en frasco de vidrio ámbar o en un frasco cubierto pon papel de aluminio. Cuidado! Algunas personas son alérgicas al iodo.
Solución concentrada : Disolver 10 g de ioduro de potasio (KI) y 5 g de iodo (I2) en 50 ml de agua destilada y completar a 100 ml.
Solución para la identificación del almidón y para coloración de bacterias (Lugol de Gram): Disolver 2 g de ioduro de potasio (KI) en 100 ml de agua destilada; agregar 1 g de cristales de iodo y completar a 300 ml con agua destilada.
En presencia del reactivo de Lugol, el almidón adquiere una coloración azul característica. La hidrólisis de la molécula de almidón libera dextrinas que, en presencia de Lugol adquieren un color marron-rojizo.
Solución para identificación de celulosa: Disolver 5 g de KI e 1 g de I2 en 330 ml de agua. La celulosa adquiere un color marron-rojizo que se pierde al lavar con agua.
BIBLIOGRAFIA
BU’LOCK J. & KRISTIANSEN B. Basic Biotechnology. London, Academic Press,1989
MAIGAN M. ET AL. Microbiologia de Brock. São Paulo, Pearson Prentice Hall, 2004.
MORITA T., ASSUMPÇÃO ROSELY M.V. Manual de soluções, reagentes e solventes. São Paulo, Editora Edgar Blücher Ltda., 1972.
12. LAS ENZIMAS EN EL LAVADO DE ROPAS
Existen diferentes tipos y precios de productos para el lavado de la ropa, con nombres genéricos tales como “Jabones para lavar” o “Sistemas de limpieza”. La composición química figura en el envase escrita en letras pequeñas, sino mínimas, y con un grado de precisión variable, dependiendo de las exigencias de la legislación local.
Su agente principal es un agente tensioactivo aniónico que actúa como surfactante. Desde el punto de vista químico, se trata de una molécula con un grupo polar, con afinidad por el agua, y otro no polar, con afinidad por aceites y grasas. Por ser al mismo tiempo hidrofílico e hidrofóbico (=lipofílico), el tensioactivo consigue reducir la tensión superficial y envolver la suciedad, formando gotitas (micelas) cargadas negativamente que se dispersan en el agua. Tanto los jabones como los detergentes derivados del petróleo tienen propiedades tensioactivas.
Dispersar la suciedad no basta. Se complementa la acción del tensioactivo con el agregado de sustancias blanqueadores y de enzimas capaces de fragmentar la materia orgánica. Otras sustancias auxiliares evitan la formación de espuma o impiden que, después de eliminada y fragmentada, la suciedad se deposite nuevamente en la prenda. También se agregan sustancias que ablandan el agua por captación de iones calcio y magnesio, y se mejora la calidad del producto con suavizantes y germicidas.
La industria sigue un procedimiento patrón para evaluar el efecto de la inclusión de una enzima en un producto destinado al lavado de ropa. Las muestras de paño manchadas con algunas sustancias típicas (huevo, tomate, aceite) son divididas en dos grupos, uno de ellos será lavado con un producto sin enzimas, el otro, con el mismo producto más la enzima correspondiente. Para eliminar la subjetividad intrínseca de las observaciones directas, los resultados son evaluados mediante un parámetro físico, denominado reflectancia, medido por espectrofotometría. La eficiencia entre los diferentes tratamientos (con y sin enzima) se expresa como la diferencia entre las reflectancias obtenidas en ambos casos.
Obviamente en el ámbito educativo no podemos reproducir este método. Pero es posible realizar algunos experimentos semejantes en los cuales se evalúen los resultados por observación directa. A pesar de su simplicidad, se trata de experiencias extremadamente versátiles y motivadoras, como las propuestas en las siguientes actividades.
De un modo general, se debe tomar en cuenta que los resultados no son absolutos. Si hoy en día el producto más eficaz es el X, en un mes el competidor Y podrá superarlo, en función de un cambio en su composición. Más importante que determinar “cuál es el mejor” es cómo lo hace: el método es más importante que las conclusiones.
Antes de comenzar cualquier actividad es indispensable saber cuál es la variable que vamos a estudiar o, en otras palabras, cuál es la pregunta que queremos responder. Se debe destacar la importancia del procedimiento y la organización de los experimentos, así como la responsabilidad de cada uno y de todos para alcanzar un resultado conclusivo.
PRIMERA PARTE: LAS ENZIMAS EN LA REMOCIÓN DE MANCHAS
OBJETIVO
Evaluar la eficiencia de las enzimas en la remoción de manchas de salsa de tomate.
MATERIALES
Una solución del producto con enzimas para lavar ropa y otra del mismo producto hervido durante 1 hora, ambos en una concentración de 4 cucharadas soperas por litro.
Salsa de tomate, 5 muestras de paño de algodón blanco (previamente lavadas y secadas), 1 molde y 1 pincel para hacer las manchas, 3 botellas de plástico, 1 marcador, 1 hoja de papel y 1 lápiz.
PROCEDIMIENTO
A. Preparación de los paños
Manchar tres veces cada paño con salsa de tomate.
Dejar secar y guardar en la oscuridad hasta la semana próxima.
B. Tratamiento de los paños
1. Separar uno de los paños manchados y guardarlo en la oscuridad (sin tratamiento).
2. Rotular las 3 botellas (agua, lavarropas biológico, lavarropas biológico hervido) y colocar 500 ml de la solución correspondiente en cada una de ellas.
3. Colocar un paño manchado en cada botella.
4. Cerrar las botellas y agitarlas, dando vuelta boca abajo 20 veces.
5. Dejar la salsa por 2 horas (mejor hasta el día siguiente).
6. Agitar nuevamente, dando vuelta boca abajo cada botella 20 veces.
7. Enjuagar los paños de las botellas, sin refregar, cambiando el agua 10 veces.
8. Retirar los paños de las botellas y, sin mezclarlos, guardarlos en la oscuridad hasta que se sequen.
9. Grapar los paños en 4 fichas, indicando el tratamiento correspondiente (control, agua, lavarropas, lavarropas biológico)
C. Evaluación
1. Evaluar la intensidad de las manchas en una escala de 0 (ausencia de mancha) a 5 (paño manchado, sin tratamiento alguno).
2. Clasificar los tratamientos en orden decreciente, en función de su eficiencia para remover las manchas de salsa de tomate.
NUESTRO COMENTARIO
En esta actividad comparamos la eficiencia en el lavado de la ropa de un producto con enzimas y del mismo producto una vez hervido durante una hora para inactivar las enzimas. Un cuidado práctico importante es completar el volumen de agua evaporada al hervir, de modo que las concentraciones de los productos sean iguales.
Las manchas de pulpa de tomate en caja son más fáciles de utilizar y analizar. Contando con varios grupos de alumnos, el procedimiento se amplía colocando más paños en las mismas botellas y soluciones. La lectura debe ser colectiva para unificar los criterios de evaluación.
Ejemplo: realizamos el experimento con muestras manchadas con salsa de tomate, colocando la salsa durante 4 horas y obtuvimos los resultados de la figura 1. La presencia de enzimas es significativa en la remoción de las manchas.
¿CÓMO MONTAR UN PROYECTO?
Estudiar otros productos para el lavado de la ropa. Sustituir el producto hervido por el correspondiente “sin enzimas” del mismo fabricante.
SEGUNDA PARTE: LA REMOCIÓN DE MANCHAS DIFERENTES
OBJETIVO
Comparar la eficiencia de varios productos con enzimas en la remoción de manchas de diferentes orígenes.
MATERIALES
Soluciones de 3 productos con enzimas para lavar ropa y 1 sin enzimas (concentración: 4 cucharadas soperas por litro); 6 muestras de paño de algodón blanco, 1 molde y 1 pincel, 3 sustancias para manchar las muestras (salsa de tomate, chocolatada y lápiz labial).
PROCEDIMIENTO
A. Preparación de los paños
Siempre en el mismo orden, manchar 5 de las 6 muestras de paño con 3 sustancias diferentes. Dejar secar y guardar en la oscuridad hasta la próxima clase.
B. Tratamiento de los paños
1. Separar 1 de los paños manchados y guardarlo en la oscuridad (sin tratamiento).
2. Rotular las botellas (agua, producto 1, producto 2, producto 3) y colocar 500 ml de la solución correspondiente en cada una de ellas.
3.Colocar un paño manchado en cada botella.
4. Cerrar las botellas y agitarlas, dando vuelta boca abajo 20 veces.
5. Dejar en remojo dos horas (o hasta el día siguiente).
6. Agitar nuevamente, dando vuelta boca abajo cada botella 20 veces.
7. Enjuagar los paños, sin refregar, cambiando el agua 10 veces.
8.Retirar los paños de las botellas y, sin mezclarlos, guardarlos en la oscuridad hasta que sequen.
9. Grapar los paños en 4 fichas, indicando el tratamiento correspondiente (control, agua, producto 1, producto 2, producto 3).
C. Evaluación
Para cada producto, evaluar la intensidad de las manchas en una escala de 0 (ausencia de mancha) a 5 (paño manchado, sin tratamiento alguno).
2. Comparar las mediciones obtenidas con los diferentes productos para cada tipo de mancha.
3. ¿Cuál producto mostró ser más eficiente?
NUESTRO COMENTARIO
Las manchas de lápiz labial deben ser realizadas con una pincelada leve, directamente o con un poco de aceite de cocina en el cual se disuelve un poquito del producto cosmético. Para evitar la subjetividad inducida por las propagandas comerciales es mejor preparar las soluciones con antelación, rotulándolas como A, B, C, etc. sin revelar “quién es quién” hasta la finalización del estudio. Los ensayos ciegos producen resultados sorprendentes.
El número de muestras puede ser calculado en función del número de grupos de alumnos (3 paños por grupo, los controles pueden ser los mismos).
El valor atribuido a la intensidad de la mancha será la medida de los valores atribuidos por los diferentes grupos, relativos al mismo tipo de mancha tratada con un producto determinado, siempre que hayan mantenido constantes las demás variables, ésto es, concentración del producto, tiempo de incubación, temperatura, agitación, número de enjuagues y secado.
Ejemplo: La experiencia fue realizada con muestras de manchas de varias sustancias (chocolatada, lápiz labial y salsa de tomate), dejadas en remojo durante 4 horas. En las condiciones del experimento, ningún producto eliminó las manchas de chocolatada y de lápiz labial. Sin embargo, Ariel y Enzimax fueron los más eficientes en remover las manchas de salsa de tomate (Figura 1).
¿CÓMO MONTAR UN PROYECTO?
Sustituir las manchas por otras de orígenes diversos: huevo, tierra, césped, grasa, etc.
Tabla. Intensidad de las manchas de diferentes sustancias (leche chocolatada, lápiz labial, salsa de tomate), luego del tratamiento con diferentes productos que contienen enzimas.
Figura 2: Resultados del experimento anterior
TERCERA PARTE: LA EFICIENCIA DE UN PRODUCTO
El desempeño de un producto para lavar ropa con enzimas varía con el tipo de mancha, pero también depende de otros factores, tal como el tiempo en que se dejan las ropas en remojo. Para aumentar la eficiencia de un producto, se pueden trabajar diferentes variables aunque siempre dentro de ciertos límites:
Concentración: Una a cuatro cucharadas soperas por litro, equivalente a 0,5% - 2% m/v. Como este valor es mucho más alto que el recomendado por los fabricantes para las máquinas de lavar, el exceso de polvo puede depositarse y manchar las muestras. Para evitar este inconveniente, conviene dejar decantar la solución y usar el sobrenadante.
Duración del experimento: entre 2 y 24 horas.
Temperatura: ambiente. Aunque sea interesante, es difícil trabajar con diferentes temperaturas sin las instalaciones adecuadas.
Agitación: en general, 10-20 veces al inicio y 10-20 veces al terminar el tiempo de incubación.
Enjuague: la mejor manera es sin refregar; llenar y vaciar el recipiente 20 veces hasta eliminar totalmente el producto. Es preferible no tocar las muestras con las manos hasta que estén bien enjuagadas, porque las enzimas pueden causar alergias.
En el caso de enjuagar con agua de la canilla (grifo), será necesario usar lentes o una bolsa de plástico como protección.
Secado: a la sombra, porque el sol y la luz fuerte alteran los pigmentos, dando falsos resultados.
OBJETIVO
Evaluar la eficiencia de un producto con enzimas sobre manchas de salsa de tomate cuando aumentamos el tiempo de remojo de las muestras de paño.
MATERIALES
Soluciones de un producto para lavar ropa con enzimas y de otro sin enzimas (concentración: 4 cucharadas soperas por litro); 6 muestras de paño de algodón blanco, 1 molde y 1 pincel, salsa de tomate, 2 botellas de plástico cortadas, 2 palitos para agitar, 1 marcador, 1 hoja de papel y 1 lápiz.
PROCEDIMIENTO
A. Preparación de los paños
Manchar 3 veces cada paño con salsa de tomate.
Dejar secar y guardar en la oscuridad hasta la clase siguiente.
B. Tratamiento de los paños
1. Separar 1 de los paños manchados y guardarlo en la oscuridad (sin tratamiento).
2. Rotular las 2 botellas (producto con enzimas, producto sin enzimas) y colocar 500 ml de la solución correspondiente en cada una de ellas.
3. Colocar 2 paños manchados en cada botella.
4. Cerrar las botellas y agitarlas, dando vuelta boca abajo 20 veces.
5. Dejar en remojo dos horas.
6. Enjuagar 1 de los paños de cada botella, sin refregar y guardarlo en la oscuridad hasta que se seque.
7. Después de 24 horas en remojo, repetir el punto anterior.
8. Grapar los paños en 4 fichas, indicando el tratamiento correspondiente (producto y tiempo de remojo).
C. Evaluación
1. Evaluar la intensidad de las manchas en una escala de 0 (ausencia de mancha) a 5 (paño manchado, sin tratamiento alguno).
2. Comparar los diferentes tratamientos y obtener las conclusiones.
NUESTRO COMENTARIO
Las manchas de pulpa de tomate en caja son fáciles de hacer y analizar. Contando con varios grupos de alumnos, el procedimiento se amplía, colocando más paños en las mismas botellas y soluciones. La lectura debe ser colectiva para unificar los criterios de evaluación.
La variable más simple es el tiempo de remojo, y el control será un producto sin enzimas, si es posible, del mismo fabricante. Este puede ser sustituido por el producto con enzimas hervido durante 1 hora. Un cuidado práctico importante es completar el volumen de agua evaporada al hervir, de modo que las concentraciones de los productos sean iguales.
Ejemplo:
Realizamos la experiencia con muestras manchadas con salsa de tomate, dejadas en remojo durante 2 o 24 horas. Se obtuvieron los resultados de la tabla de abajo fotografiados en la figura 3. En las condiciones del experimento, el aumento del tiempo de remojo mejoró ligeramente el desempeño de los productos.
¿CÓMO MONTAR UN PROYECTO?
De los factores que inciden en el desempeño de un producto, tal vez los más interesantes sean la temperatura y la concentración del producto.
Tabla 2: Intensidad de las manchas de salsa de tomate en los paños dejados en remojo con diferentes productos (sin y con enzimas) durante tiempos variables (2 horas, 24 horas).
13. OBTENCIÓN DE UN POLÍMERO (CELULOSA BACTERIANA)
La celulosa es el polímero más abundante de nuestro planeta. Además de ser uno de los principales constituyentes de la pared celular de las plantas, la celulosa tiene numerosas aplicaciones industriales (vestimenta, papel).
Las bacterias Gram negativas de la familia Acetobacter se desarrollan en condiciones aerobias. La transformación de carbohidratos como el etanol en ácido acético (fermentación acética) es el fundamento de la producción de vinagres.
Acetobacter xylinum es una bacteria del suelo que puede ser aislada de frutas caídas al suelo. Como parte del metabolismo de la glucosa, sintetiza subunidades de celulosa que son liberadas por extrusión al medio a través de los poros de la pared celular. La unión de esas microfibrillas forma una película que retiene a las bacterias formando un biofilm sobre el sustrato en descomposición.
Desde el punto de vista metabólico, la celulosa es un metabolito secundario sintetizado cuando las condiciones del medio son satisfactorias desde el punto de vista nutritivo. Diversas investigaciones indican que en Acetobacter xylinum, la síntesis de la celulosa estaría controlada por un operón.
Algunas de las principales aplicaciones de la celulosa de origen bacteriano: Membranas para “headphones”, Espesantes de alimentos, de pinturas, de tintas y de sustancias adhesivas,PProtección de heridas (quemaduras) antes de un trasplante de piel.
BIBLIOGRAFÍA
CANNON, R et al. Acetobacter xylinum: an inquiry into cellulose biosynthesis. The American Biology Teacher 62:6, 2000.
OBJETIVO
Obtener hojas de celulosa a partir de un cultivo de Acetobacter xylinum.
MATERIALES
Vinagre fuerte (6-8% de acidez) preparado como se indica en la Guía 04, 1 saquito de té (1 g), 2 cucharas de azúcar, recipientes adecuados, paño de algodón, elástico, film de PVA.
PROCEDIMIENTO
1. Preparar una infusión con 1 g de té en 500 ml de agua hervida.
2. Disolver bien 2 cucharadas soperas de azúcar.
3. Dejar esfriar hasta alcanzar la temperatura ambiente (30ºC es la temperatura ideal).
4. Agregar 50 ml de vinagre fuerte.
5. Distribuir en recipientes de vidrio o de plástico, llenando hasta mitad.
6. Cerrar cada recipiente con 1 paño de algodón, ajustado con un elástico. Incubar en la oscuridad.
7. Esperar al menos de 7 a 10 días para observar el crecimiento de una capa viscosa en la superficie.
8. Retirar la capa viscosa de la superficie, lavar y dejar secar sobre una superficie cubierta con film de PVA, para que no se pegue.
NUESTRO COMENTARIO
Esta actividad representa un desdoblamiento de las actividades relacionadas con la producción de vinagre. En el vinagre fuerte, coexisten diferentes especies de la familia Acetobacter. Los vinos suaves favorecen el crecimiento de A. Xylinum y por lo tanto de la capa gelatinosa. Los vinos secos favorecen el crecimiento de A. aceti, formándose una capa gelatinosa menor.
En este caso, el vino es sustituido por una infusión de té azucarado, que aporta los nutrientes necesarios para el microorganismo. La capa gelatinosa puede requerir varios lavados para la eliminación del azúcar remanente. Con una manipulación cuidadosa se pueden obtener hojas de celulosa, tal como se observa en la figura.
NUESTRO COMENTARIO
Esta actividad es un desdoblamiento de las que se relacionan con la producción de vinagre. En el vinagre fuerte, coexisten diferentes especies de la familia Acetobacter. Vinos suaves favorecen el crecimiento de A. xylinum y, por lo tanto, de la camada gelatinosa. Vinos secos favorecen el crecimento de A. aceti, formándose una camada gelatinosa menor.
En este caso, el vino es substituído por una infusión de té azucarada que dará los nutrientes necesarios al microorganismo.
Una vez formada, la camada gelatinosa puede demandar varios lavados para retirar el azúcar remanescente. Con una manipulación cuidadosa, se pueden obtener hojas de celulosa de tamaño A4 como las que se muestra en la figura.
¿CÓMO ARMAR UN PROYECTO?
- Probar con diferentes tés y con un medio de cultivo definido, como el que figura en anexo.
- Probar con agua de coco. En las Filipinas existe un postre llamado nata de coco, que se prepara de forma análoga.
- Comparar los resultados obtenidos con diferentes tipos de azúcar (azúcar moreno y azúcar cristal).
- Comparar los resultados obtenidos con diferentes cantidades de azúcar (0 g, 40 g y 60 g).
MEDIO LÍQUIDO DEFINIDO PARA EL CULTIVO DE Acetobacter xylinum
Glucose 20 g
Extracto de levadura 5 g
Peptona 5 g
Fosfato de sodio dibásico 2,7 g
Ácido cítrico 1,15 g
Agua destilada 1.000 ml
pH: 6,6-6,8
BIBLIOGRAFIA
CANNON, R et al. Acetobacter xylinum: an inquiry into cellulose biosynthesis. The American Biology Teacher 62:6, 2000.
La denominación de biopolímeros abarca dos tipos de moléculas. El primero incluye aquellas sintetizadas por los seres vivos, como la celulosa, el almidón o los aceites vegetales; el segundo, las que resultan de la polimerización de una molécula básica proveniente de una fuente renovable, como el ácido láctico. La alteración de la estructura de un biopolímero mediante un agente dispersante lo transforma en un bioplástico.
PRIMERA PARTE: BIOPLÁSTICOS RÍGIDOS DE ALMIDÓN
La transformación de un polímero de origen biológico en bioplástico ocurre cuando se altera su estructura con alguna sustancia dispersante. En esta actividad, el aceite vegetal cumple la función de agente dispersante del almidón (polisacárido).
OBJETIVO
Preparar un bioplástico a partir de almidón y aceite vegetal.
MATERIALES
Maicena, agua, aceite vegetal, colorante de alimentos, bolsas plásticas, horno de micro-ondas.
Medidas: 1 cuchara sopera de maicena = 8g; 1 cuchara sopera de agua = 15 ml.
PROCEDIMIENTO
1. Mezclar en una bolsa de plástico 2 cucharadas soperas de almidón, 2 cucharadas soperas de agua y unas gotas de colorante de alimentos.
2. Agregar 4 o 5 gotas de aceite vegetal en la bolsa de plástico y mezclar muy bien el contenido.
3. Cerrar la bolsa dejando una abertura en la punta.
4. Calentar en el microondas durante 30 o 40 segundos.
5. Esperar que la temperatura baje y distribuir en moldes.
6. Dejar secar a temperatura ambiente.
7. Analizar algunas de las características del bioplástico obtenido (dureza, flexibilidad, degradabilidad, por ejemplo).
Control: Repetir el procedimiento reemplazando en el punto 2, el aceite vegetal por agua.
NUESTRO COMENTARIO
Se trata de una actividad muy simple que siempre resulta exitosa (Figura).
En el momento de retirar la bolsa de plástico del microondas se debe tener extremo cuidado para evitar quemaduras.
A medida que el plástico se va secando, pierde flexibilidad y luego de 1 o 2 días queda rígido.
Figura. Diferentes momentos en la preparación del bioplástico. De izquierda a derecha, la bolsa de plástico antes de entrar en el microondas; la misma bolsa de plástico, luego de 30 segundos en el microondas; el plástico unas horas después, conservando todavía alguna flexibilidad.
¿CÓMO MONTAR UN PROYECTO?
- Comparar los bioplásticos obtenidos con diferentes fuentes: maicena, harina de trigo, fécula de papa (patata), fécula de mandioca, etc.
- Comparar los bioplásticos obtenidos con diferentes dispersantes: aceite de soja, aceite de girasol, aceite de maíz. etc.
- Modificar las proporciones de maicena y aceite.
- A transformação de um polímero de origem biológica em bioplástico ocorre quando se altera sua estrutura com alguma substância dispersante. Nesta atividade, o óleo vegetal cumpre a função de agente dispersante do amido (polissacarídeo).
BIBLIOGRAFÍA
FIELD GUIDE TO UTAH AGRICULTURE IN THE CLASSROOM. Make your own Bioplastic stuff in your microwave.
SEGUNDA PARTE: BIOPLÁSTICOS FLEXIBLES DE ALMIDÓN
Los plásticos flexibles pueden prepararse a partir de un biopolímero como el almidón, utilizando el glicerol como agente plastificante. El almidón es hidrolizado parcialmente en medio ácido y alta temperatura.
El glicerol aumenta el volumen libre entre las cadenas de amilasa y amilopectina liberadas, reduciendo las interacciones entre ambas y favoreciendo el movimiento de una en relación con la otra.
OBJETIVO
Preparar bioplásticos de almidón.
MATERIALES
Estufa, baño maría a 100 grados Celsius, agitador magnético (eventualmente), 5 g de almidón de maíz (o de papa), 40 ml de agua destilada, HCl 0,1 M, NaOH 0,1 M, glicerina comercial, colorante de alimentos, una bandeja de telgopor de aproximadamente 20 x 14 cm.
PROCEDIMIENTO
1. Colocar en un vaso de precipitados 5 g de almidón de maíz. Agregar, mezclando bien, 40 ml de agua destilada, 4 ml de glicerina 50% (v/v), 6 ml de HCl 0,1 M y unas gotas de colorante de alimentos.
2. Mantener aproximadamente 10 minutos en baño maría, en hervor, agitando continuamente, hasta que la mezcla quede viscosa. Adicionar de 2 a 8 ml de NaOH 0,1M, para disminuir la viscosidad.
3. Verter la mezcla en una bandeja de telgopor, como las que se usan en los comercios para los productos alimenticios.
4. Secar en la estuf.
RESULTADOS
Analizar las características del bioplástico obtenido (solubilidad en agua, biodegradabilidad, resistencia, flexibilidad, combustibilidad).
NUESTRO COMENTARIO
Este protocolo era incluido regularmente en nuestros cursos .con algunas variaciones basadas en cambios de concentración de glicerina porque de este modo se originan plásticos con diferentes propiedades.
Desde el punto de vista técnico, vale la pena destacar que el secado en la estufa puede ser reemplazado por el secado al sol y que los mejores moldes son las bandejas de telgopor que se usan en los comercios para acondicionar los alimentos.
También comprobamos que tanto las hojas para separar alimentos como los films de PVC permiten guardar los bioplásticos obtenidos sin que las piezas se peguen entre sí.
¿CÓMO ARMAR UN PROYECTO?
- Elaborar bioplásticos, adaptando la práctica para almidones de diferente origen (papa blanca, mandioca).
- Comparar las propiedades de los bioplásticos obtenidos con diferentes materias primas.
- Investigar cómo adaptar la práctica para obtener un bioplástico aceptable a partir de almidón de papa o de mandioca.
COMO MONTAR UM PROJETO
- Elaborar bioplásticos, adaptando o roteiro para amidos de diferente origem (batata inglesa, mandioca).
- Comparar as propriedades dos bioplásticos obtidos com diferentes matérias-primas.
- Investigar como adaptar o roteiro para obter um bioplástico aceitável a partir de amido de batata ou de mandioca.
BIBLIOGRAFÍA
La transformación de un polímero de origen biológico en bioplástico ocurre cuando se altera su estructura con alguna sustancia dispersante. En esta práctica, la glicerina cumple la función de agente dispersante de la gelatina (proteína).
OBJETIVO
Preparar un bioplástico a partir de gelatina y glicerina.
MATERIALES
Un paquete de gelatina blanca comercial (12 g), glicerina comercial, tubos de ensayo, vasos de precipitados, pipetas, espátula, varilla, agua, moldes, horno de microondas, balanza.
PROCEDIMIENTO
1. Preparar 10 ml de una solución de glicerina 1:20 (0,5 ml de glicerina + 9,5 ml de agua).
2. Preparar 10 ml de una solución de glicerina 1:5 (2 ml de glicerina + 8 ml de agua).
3. Distribuir 4 g de gelatina en cada vaso de precipitados y agregar 10 ml de agua en cada uno.
4. Colocar los 3 vasos de precipitados en el microondas (potencia alta, 15 segundos) para disolver la gelatina. Mezclar bien.
5. Agregar 10 ml de agua en el primer vaso de precipitados, 10 ml de la solución de glicerina 1:20 en el segundo y 10 ml de la solución de glicerina 1:5 en el tercero.
6. Calentar nuevamente el contenido de los vasos de precipitados en el microondas (potencia media, 45 segundos). Mezclar bien y distribuir en los moldes.
7. Dejar secar en la estufa (40ºC).
8. Analizar las características (resistencia, combustión, biodegradación), de los bioplásticos obtenidos, en relación con el control.
NUESTRO COMENTARIO
Bioplásticos de gelatina fue el tema desarrollado por Este tema fue estudiado por Gabriel Politzer Couto e Guilherme Fagundes Pagotto en su trabajo de finalización del Curso Técnico (Nivel Medio) de Biotecnología (2010).
Utilizamos los moldes que se venden para la elaboración de jabones, pero sirve cualquier recipiente. Los plásticos deben estar bien secos para despegar del molde.
A medida que la concentración del agente dispersante aumenta, los plásticos ganan flexibilidad (Figura). Con concentraciones superiores, obtuvimos plásticos pegajosos, con una consistencia parecida a la goma. Los separadores de alimentos o el film de PVC permiten conservar los plásticos sin que se peguen entre sí.
La gelatina blanca puede ser sustituida por gelatina de color sin sabor. También pueden agregarse unas gotas de colorante de alimentos. Las gelatinas diet son interesantes desde el punto de vista del color, pero dan productos mucho más flexibles y no sabemos si se debe a que están en menor concentración o porque llevan muchos aditivos.
¿CÓMO ARMAR UN PROYECTO?
- Comparar los bioplásticos obtenidos con diferentes concentraciones de glicerina.
- Comparar los bioplásticos obtenidos reemplazando la gelatina por caseína, que es otra proteína.
- Observación: la extracción de caseína figura en la Guía 43 (Biopolímeros: extracción de caseína).
BIBLIOGRAFÍA
STEVENS, E.S. Make your own green plastic.
MALAJOVICH, M.A.M. de. Biotecnología, 2ª edición actualizada. Bernal, Editorial de la Universidad Nacional de Quilmes, 2012.
Figura: A la izquierda, un momento de la preparación; a la derecha, flexibilidade diferencial de los bioplásticos de gelatina obtenidos con concentraciones diferentes del agente dispersante (glicerina).
16. PLÁSTICOS Y DERIVADOS DE CASEÍNA
La caseína es la principal proteína de la leche, y está presente como una sal de calcio soluble (3%m/v). Precipita con la adición de ácidos, lo que posibilita su extracción. En la industria ese proceso es realizado con ácido clorhídrico o sulfúrico, o con una enzima (renina). La caseína es la materia prima en la fabricación de alimentos (quesos), colas, tintas y materiales plásticos (galalita).
Colas
Hasta comienzos de este siglo, las principales materias primas utilizadas como cola eran de origen biológico, tales como sangre de algunos animales o resinas naturales extraídas de hojas y troncos de algunos árboles.
En la actualidad, se dispone de una gran variedad de colas producidas industrialmente a partir de sustancias sintéticas con la finalidad de adaptarse a nuevos materiales (polímeros, cerámicas especiales y aleaciones metálicas modernas).
No obstante, las colas naturales son aún recomendadas para algunas aplicaciones domésticas, como la adhesión de papeles o piezas de madera en la construcción de pequeños objetos. Además de una fácil preparación, la cola de caseína presenta un poder de adhesión considerable. En la Primer Guerra Mundial fue utilizada en la construcción de aviones, cuya estructura estaba compuesta, casi exclusivamente, por piezas de madera.
Pinturas
Muchas pinturas comerciales están compuestas por una suspensión de pigmentos coloridos en una sustancia que permite esparcirlas en un papel o tela. En este caso el vehículo es la caseína.
Plásticos
Los plásticos de caseína (galalita) fueron exhibidos por primera vez en la exposición de Paris de 1900 y durante años fueron utilizados en la confección de botones, joyas y bolígrafos. A pesar de la búsqueda de alternativas al pasaje por formol (que es tóxico), las tentativas de modernización de su proceso productivo fracasaron. La galalita dejo de ser producida comercialmente en 1980.
OBJETIVO
Preparar cola, tinta y plástico a partir de un biopolímero, la caseína.
MATERIALES
Leche descremada (desnatada), vinagre o limón, filtro de paño, bicarbonato de sodio, Merthiolate, colorantes de alimentos, tapas de gaseosas (moldes), formol, material básico de laboratorio.
Cuidado! El formol es tóxico.
PROCEDIMIENTOS
A. Extracción de caseína
1. Calentar 100 ml de leche descremada a 50 grados Celsius.]
2. Agregar lentamente vinagre o limón, hasta que la leche cuaje.
3. Filtrar, para separar la caseína.
4. Lavar la caseína para retirar todo el suero y filtrar nuevamente.
B. Preparación de cola
1. Agregar 1 g de bicarbonato de sodio a la caseína.
2. Agregar poco a poco 10 a 15 ml de agua hasta obtener la consistencia adecuada.
3. Colocar una o dos gotas de Merthiolate como conservante.
4. Realizar los controles correspondientes.
C. Preparación de pinturas
1. Agregar agua a una cantidad de caseína equivalente a una moneda hasta obtener una masa espesa.
2. Colocar unas gotas de algún colorante de alimentos y mezclar bien.
3. Realizar los controles correspondientes.
D. Obtención de galalita (bioplástico)
1. Comprimir bien la caseína y darle alguna forma como, por ejemplo, de dado, esfera, disco, etc.
2. Sumergir el material en formol 30-40% (cuidado, es tóxico!) y dejar en reposo durante al menos una semana. Lavar bien y dejar secar al aire.
3. Analizar las características del bioplástico obtenido (solubilidad en agua, biodegradabilidad, resistencia, combustibilidad).
NUESTRO COMENTARIO
Se trata de una actividad clásica, sin mayores complicaciones. Altamente motivadora, muestra algunas aplicaciones de un bioplímero en la industria. Las figuras 1, 2 y 3 muestran los primeros experimentos realizados por nuestros alumnos y presentados en la Semana Nacional de Ciencia y Tecnología (2005).
Por motivos de seguridad, las sales inorgánicas utilizadas tradicionalmente fueron reemplazadas por colorantes de alimentos.
El formol debe ser manipulado por el profesor bajo campana en el Laboratorio de Química.
Figura 1. Cola de caseína: Preparación de cola y utilización de la cola con papeles
Figura 3. Discs de galalita
BIBLIOGRAFIA
BEHMER, M. L. A.; Tecnologia do leite. 15a Ed. São Paulo: Livraria Nobel, 1984.
Los detergentes, utilizados en la limpieza de objetos, son compuestos formados por moléculas complejas de largas cadenas de carbono que llevan en una de sus extremidades una estrutura polar, que las torna solubles en agua, y en la otra una estructura apolar que permite solubilizar grasas.
Como los detergentes pueden ser una fuente de contaminación ambiental, es importante que sean biodegradables, o sea que su estructura pueda ser degradada por acción bacteriana.
OBJETIVO
Acompañar la biodegradación de un detergente por bacterias ambientales.
MATERIAL
2 botellones, 1 probeta de 100 mL, régua, detergente en polvo, medio nutriente diluído, suelo fresco, 2 bombas de acuario o una con conexiones para dos botellones, 1 agitador de uso doméstico, conexões plásticas, 2 piedras porosas.
PROCEDIMIENTO
RESULTADOS
1. Anotar los datos en una tabla. Considerar las medias inicial y final y el desvío patrón. Los valores indican la cantidad (mL) de espuma formada por el detergente y su degradación a lo largo del tiempo.
2. Representar graficamente (diagrama de barras) la cantidad de espuma en A yB al iniciar y al concluir el experimento.
3. Interprete sus observaciones.
NUESTRO COMENTARIO
Puede substituirse el detergente en polvo por detergente líquido.
La dificultad principal es la padronización de la agitación. Nosotros utilizamos unos agitadores vendidos para hacer espuma en cafés del tipo capuccino. Cualquiera sirva siempre que se conserven las condiciones de agitación (tiempo e intensidad).
Los resultados se vuelven confiables cuando se aguardan a partir de 5 minutos después de acabar con la agitación. La espuma disminuye siguiendo una curva exponencial y los valores son más estables a partir de ese intervalo. En el primer momento las variaciones son muy grandes (error de medición).
Los detergentes biodegradables están formados por cadenas lineares de carbono. Los detergentes de cadena ramificada que no pueden ser biodegradados, están prohibidos. Formaban camadas gigantescas de espuma en los cursos de agua sofocando las diferentes formas de vida. que allí se encontraban.
18. BIODEGRADACIÓN DE ACEITES Y GRASAS
Aceites y grasas pertenecen a un grupo de lípidos, denominados glicéridos. La molécula de un glicérido se forma mediante la unión de un alcohol (glicerol) con 3 moléculas de ácidos grasos. Los glicéridos de origen animal son generalmente sólidos, como la manteca y la grasa de las carnes. Los de origen vegetal son casi siempre líquidos como los aceites de oliva, de girasol o de soja. Las margarinas son aceites vegetales solidificados artificialmente, por hidrogenación.
Exoenzimas bacterianas (lipasas) hidrolizan las moléculas de los lípidos formando glicerol y ácidos grasos que dan el flavor rancio y el aroma característicos. Algunas bacterias fermentam el glicerol, otras oxidan los ácidos grasos.
La descomposición de lípidos en los sistemas de tratamiento de aguas residuales es un proceso lento que requiere gran cantidad de oxígeno. Cultivos bacterianos se utilizan para degradar la grasa de los efluentes de restaurantes e industrias processadoras de carne.
MATERIAL
Garrafas, aceite, agua, una suspensión bacteriana (Gorduraklin, por ejemplo), papel pardo, uma vareta de vidro fina.
PROCEDIMIENTO
RESULTADOS
Comparar las medias de los diámetros de las manchas.
NUESTRO COMENTARIO
Es una actividad que requiere mucha paciencia y cuidado. Otra posibilidad es buscar las bacterias utilizando un medio mínimo de agar-aceite. El aceite se agrega al medio de sales minerales en una proporción de 1% y se agita a velocidad alta durante 5 minutos.Se transfiere el medio a una botella y se esteriliza.
19. PROSPECCIÓN DE BACTERIAS DEGRADADORAS DE GASOLINA
La selección se realiza en un medio de sólido de agar con sales minerales, de manera tal que la única fuente de carbono sea la gasolina. Bacterias que la degraden obtendrán así carbono y energía que posibiliten su crecimiento y multiplicación.
OBJETIVO
Selecionar bactérias capazes de degradar gasolina
MATERIALES
2 placas de Petri A e B con medio mínimo (sales minerales) y agar (1,5%); gasolina (# 10 mL); suelo cercano a alguna gasolinera mezclado con algunos ml de água; cotonete estéril o alza de Drigalsky. El medio mínimo puede ser substituído por 1-2 gotas de fertilizante con nitrógeno y fósforo en 100 ml de agua.
PROCEDIMIENTO
NUESTRO COMENTARIO
La probabilidad de seleccionar esas bacterias aumenta si se colecta la muestra en una estación de servicio. Una vez obtenidas, se puede verificar su eficiencia cultivándolas en medio mínimo líquido con diferentes concentraciones de combustible.
El control permite diferenciar, eventualmente, las bacterias degradadoras de gasolina de las bacterias degradadoras de agar.
BIBLIOGRAFÍA
CHRISTINE CASE Bioremediation - Sheen Screen
21. EXTRACCIÓN DE ACEITE DE COCO
El coco es el fruto de Cocus nucifera (familia Arecaceae), un árbol originario de Asia. Cumple un importante papel socio-económico como materia-prima para diversas industrias (alimentos, cosmética, téxtil).
La pulpa del coco seco o copra contiene más de 60% de aceite. Rico en ácido láurico, el aceite de copra no es degradado a altas temperaturas.
OBJETIVO
Extraer y caracterizar el aceite de la pulpa del coco (copra).
MATERIALES
Coco seco, béquer de vidrIo, horno de microondas, cuchillo afilado, licuadora, embudo, botella plástica, globo y elástico, tijera, colador, funil, garrafa plástica, balão e elástico, tesoura, coador, recipiente tipo fuentón.
El uso del horno de microondas para separar el aceite de la pulpa es conveniente porque no se desprende humo. No se debe utilizar material de polipropileno porque se derrite; preferir material de vidrio o apropiado para microondas.
PROCEDIMIENTO
Extracción del aceite
1. Agujerear el fruto para retirar el agua.
2. Abrir los cocos.
3. Retirar y picar la polpa en pedazos chicos.
4. Licuar la pulpa con agua del propio coco hasta que se forme una pasta.
5. Exprimir esa pasta en un fuentón, separando lo que se pueda de la masa de la leche de coco.
6. Con embudo, transferir la leche de coco a una botella plástica y dejarla e en un lugar oscuro durante 48 horas (fermentación).
7. Colocar a botella en la heladera; el aceite de coco y el resto de la pulpa formarán una camada sólida en la parte superior.
8. Con una tijera abrir la botella y retirar esa mezcla sólida.
9. Calentar en el microondas hasta que el aceite quede líquido, "friendo" la parte de pulpa que había sobrado.
10. Colar el aceite, separándolo de la pulpa.
11. Conservar ambos produtos en la heladera.
12. Calcular el rendimiento (V/m% e m/m%) del procedimiento.
Observación: De tres extracciones realizadas con este método, el mejor rendimiento fué el último (17,6%).
13. Determinar el punto de fusión del aceite extraído. La figura muestra el montaje utilizado (PF: 22 graus Celsius)
NUESTRO COMENTARIO
A extracción de aceite de copra fué una de las actividades desarrolladas con éxito por Allan Schechter, Ingrid Amaral e Pedro Thiengo en su trabajo de finalización del Curso Medio Técnico de Biotecnologia, titulado “El coco (Cocus nucifera) como materia-prima”.
Las imágenes ilustran varias etapas del trabajo realizado.
COMO MONTAR UM PROJETO
- Modificar la técnica de modo a melhorar o rendimento da extração.
- Adaptar la técnica para la extracción de aceite de palta (aguacate).
Un trabajo, también desarrollado por Allan Schechter, Ingrid Amaral e Pedro Thiengo, que permite ilustrar e concepto de biorrefineria, a partir de materiales del cotidiano.
23. LOS RIZOBIOS Y LAS LEGUMINOSAS
Una de las relaciones benéficas para la agricultura es la que ocurre entre la bacterias fijadoras de nitrógeno y las plantas leguminosas (poroto, soja)
OBJETIVO
Visualizar los nódulos de bacterias fijadoras de nitrógeno (rizobios) en las raíces de soja.
MATERIALES
2 vasos para plantas, semillas de soja, tierra de jardin, arena, vasos plásticos, agua, inoculante con bacterias fijadoras de nitrógeno (Bradirhizobium japonicum o Rhizobium leguminosarum bv.Phaseoli), estufa, balanza.
PROCEDIMIENTO
Colocar en remojo, durante 24 a 48 horas, unas 12 semillas de soja.
1. Mezclar la tierra con arena (proporción 2:1).
2. Distribuir la mezcla en las dos macetas.
3. Ena de las macetas, introducir 5 semillas en la tierra, a una profundidad equivalente a 3 veces el tamaño de la semilla.
4. Diluir los rizobios en la proporción indicada por el fabricante.
5. Colocar las semillas restantes en la solución anterior y dejar algunos minutos antes de proceder a la siembra en la otra maceta coo en el item 3.
6. Regar las plantas a cada dos días hasta estar suficientemente crecidas como para necesitar una riega diaria.
7. Acompañar el crecimiento de las plantas registrando la cantidad de semillas germinadas, el tamaño del tallo, el número de hojas, la aparición y caída de los cotiledones, la formación de flores y vainas.
8. Retirar las plantas de los macetones y observar los nódulos en las raíces de las plantas.
9. Comparar el desarrollo de las plantas inoculadas y el de las plantas no inoculadas (control), incluyendo la masa seca.
NUESTRO COMENTARIO
Esta actividad demora varios meses y requiere una buena dosis de paciencia y dedicación, pero el resultado compensa. En otra ocasión, un grupo de alumnos trató de cultivar las semillas inoculadas en un medio de agar-agua. Los resultados fueron interesantes, aunque las plantas no crecen bien los nódulos fueron bien visibles.
Figura: De izquierda a derecha, rizobios en raíz de soja cultivada en tierra (x20); raíz de soja cultivada en agar.
24. LA SOJA COMO MATERIA PRIMA
En construcción. Otra tentativa de recrear el concepto de biorrefinería.