BIOTECNOLOGIA E PRODUÇÃO
GUIAS DE ATIVIDADES
BIOPROCESSOS
02. Imobilização de leveduras em alginato
03. Fermentação: leveduras livres vs. imobilizadas
04. A acetificação: fundamentos técnicos
05. O processo lento de produção de vinagre
06. Como montar um gerador para a acetificação
07. O processo rápido de produção de vinagre
08. Produção de biomassa de Spirulina (Arthrospira)
ENERGIA
INDUSTRIA: ENZIMAS, BIOPOLÍMEROS E BIOPLÁSTICOS
11. Microrganismos produtores de enzimas
12. As enzimas no lavado das roupas
13. Obtenção de um biopolímero (celulose bacteriana)
16. Plásticos e derivados de caseína
BIORREMEDIAÇÃO
17. Biodegradação de detergentes
18. Biodegradação de óleos e gorduras
19. Triagem de bactérias degradadoras de gasolina
20. Biocorrosão e anticorrosivos
A INTEGRAÇÃO DOS PROCESSOS INDUSTRIAIS
23. Os rizóbios e as leguminosas
APRESENTAÇÃO
Galeria de imagens
































Em ambientes úmidos, algumas bactérias secretam substâncias poliméricas pegajosas que facilitam sua adesão a uma superfície qualquer e a formação de biofilmes. Na natureza, os biofilmes compreendem uma mistura de espécies bacterianas, fungos, algas, leveduras, protozoos, destroços e resíduos de corrosão. Havendo nutrientes e umidade, todo tipo de superfície pode ser colonizado por um biofilme: pedras, metais, implantes médicos, escovas de dentes etc.
Qualquer processo industrial que se desenvolva em meio aquoso pode ser contaminado por biofilmes, causando danos importantes como a contaminação da água, a corrosão e a obstrução de dutos. Na área da saúde humana, mais de 500 espécies bacterianas foram identificadas na placa dental, um biofilme que favorece várias doenças periodontais. A persistência de algumas infecções na orelha média (otite) e no trato urinário, por exemplo, se deveria à proteção encontrada pelos agentes infecciosos dentro do biofilme, onde os antibióticos dificilmente chegam.
BIBLIOGRAFIA
CENTER FOR BIOFILM ENGINEERING (University of Montana). Biofilm basics.
OBJETIVO
Comparar a formação de biofilmes em suportes que receberam diferentes tratamentos.
MATERIAIS
Copos plásticos ou de vidro de 400 ml, água de charco, fertilizante para plantas, 3 lâminas de plástico PET de 10 x 3 cm, linha de nylon e agulha, pedrinhas, esmalte de unhas, vaselina.
PROCEDIMENTO
1. Preparar as lâminas de PET como indicado no esquema ao lado.
2. Passar vaselina em uma das lâminas e esmalte de unhas na outra. A terceira será o controle.
3. Inserir cada lâmina em um copo, previamente rotulado.
4. Encher os copos com a água de charco e acrescentar umas gotas de fertilizante para plantas.
5. Incubar na luz.
6. Acompanhar o desenvolvimento dos filmes periodicamente, durante várias semanas.
7. Observar as três lâminas no microscópio estereoscópico.
NOSSO COMENTÁRIO
Como evidenciado na figura abaixo, trata-se de uma atividade muito simples que permite introduzir o conceito de biofilmes sem nenhuma dificuldade. Também permite comparar a eficiência de diversos tratamentos na proteção de materiais submersos.
Figura: Formação de biofilmes. De esquerda a direita, montagem do experimento; o experimento; detalhe do biofilme na lâmina com vaselina.
COMO MONTAR UM PROJETO
- Testar o efeito de outras substâncias.
- Testar a adesão a outros suportes.
- Levar o experimento para um ambiente natural, como mostrado no esquema abaixo.
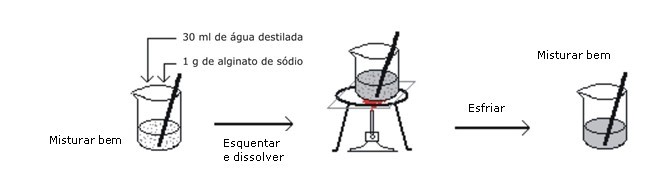
02. IMOBILIZAÇÃO DE LEVEDURAS EM ALGINATO
As técnicas de imobilização aplicam-se tanto às células como aos microrganismos e às enzimas. Suas principais vantagens são facilitar a separação do produto e permitir a recuperação do agente biológico. Em geral, utilizam-se com agentes biológicos difíceis de obter ou de preços elevados.
A técnica de imobilização em alginato de sódio é relativamente simples. Dissolve-se o alginato de sódio em um pouco de água quente, misturando-o, depois de frio, às leveduras. Deixa-se cair a mistura, gota a gota, em uma solução de cloreto de cálcio. Com o intercâmbio de íons cálcio (do meio) e sódio (do alginato) cria-se uma matriz de alginato de cálcio que retém as leveduras.
Apesar de ter consistência sólida, essa matriz permite a circulação de substâncias, de modo que os agentes biológicos conservem sua atividade metabólica. Uma vez acabadas as transformações químicas esperadas, as bolinhas de alginato e levedura se recuperam facilmente.
MATERIAL
Balança, bico de Bunsen, tripé e tela, 3 béqueres de 100 ml, 1 proveta de 50 ml, 1 espátula, 5 seringas de 10 ml (sem agulhas), 2,5 g de fermento biológico seco instantâneo (levedura), 1 g de alginato de sódio, água destilada, 1 colher plástica, 1 béquer com 500 ml de solução de cloreto de cálcio a 2%, 1 coador, 1 béquer com uma solução de sacarose (10%), 1 fermentador construido como indicado em Enzimas e Fermentações
PROCEDIMENTO
1. Dissolver o alginato de sódio.
Conservar as esferas de alginato de cálcio com as leveduras imobilizadas na solução de cloreto de cálcio a 2%. Aguardar 24 horas antes de iniciar a primeira fermentação.
5. Primeira utilização das leveduras imobilizadas.
Separar as esferas com um coador (d=6 cm) e depois de lavá-las com água destilada
6. Colocá-las no fermentador (solução de sacarose a 10%) para iniciar a fermentação.
7. Recuperação e acondicionamento
Concluída a fermentação, coar novamente as esferas e lavá-las com água destilada. Conservar as leveduras imobilizadas na geladeira, em uma solução de cloreto de cálcio (2%).
NOSSO COMENTÁRIO
As leveduras imobilizadas sobrevivem bastante tempo no cloreto de cálcio. Contudo, convém colocá-las para fermentar de vez em quando. O alginato de sódio deve ser puro e de boa qualidade; não obtivemos bons resultados com o que é vendido em lojas de produtos alimentícios, mas talvez seja necessário aumentar e ajustar a concentração.
Assim com as enzimas e as leveduras, outros organismos como Arthrospira (Spirulina) também podem ser imobilizados em alginato de cálcio.
A imobilização de células ou enzimas em um biorreator permite que a condução de um bioprocesso passe de descontínua a contínua, evitando a perda de agentes biológicos difíceis de obter ou de alto custo. Essa tecnologia encontra aplicações na produção industrial de aminoácidos, ácidos orgânicos etc.
A imobilização se aplica a todos os tipos celulares (bactérias, fungos, células vegetais e animais), sendo vantajosa quando o bioprocesso demanda várias reações consecutivas, já que, como parte de seu metabolismo, uma célula pode operar diretamente várias etapas de um processo fermentativo. Também facilita a separação do produto e permite a recuperação do agente biológico que pode ter um preço elevado ou ser difícil de obter. Uma das técnicas mais frequentemente utilizadas é a imobilização em alginato de cálcio.
OBJETIVO
Comparar a ação fermentativa de leveduras livres e leveduras imobilizadas em alginato de cálcio.
MATERIAL
Balança, 2 fermentadores, 1 coador, água destilada, solução de sacarose a 10 % ou suco de frutas adicionado de açúcar, 1 g de fermento biológico seco instantâneo, 1 g de fermento seco instantâneo previamente imobilizado em alginato de cálcio.
PROCEDIMENTO
1. Distribuir nos fermentadores uma quantidade igual de substrato.
2. Inocular o primeiro com levedura livre.
3. Inocular o segundo com levedura imobilizada, previamente lavada para retirar o cloreto de cálcio.
4. Acompanhar periodicamente o processo fermentativo mediante a pesagem dos fermentadores e/ou a contagem do número de bolhas x minuto.
5. Observar o movimento vertical das esferas de alginato de cálcio durante a fermentação. Devido ao CO2 acumulado na superfície, as esferas tornam-se mais leves e sobem até a superfície. Ali, liberam o gás e descem novamente.
6. Finalizada a fermentação, coar e lavar as bolinhas de levedura imobilizada em alginato de cálcio e guardá-las na geladeira.
7. Analisar e interpretar os dados.
NOSSO COMENTÁRIO
Colocamos 500 ml de suco de goiaba + 100 ml de solução de açúcar (proporção 1:1 v/v) em cada fermentador. Acrescentamos 1 g de leveduras livres no primeiro e 1 g de leveduras imobilizadas no segundo. Acompanhamos diariamente a fermentação medindo a massa e o numero de bolhas liberado por minuto. Os dados estão representados nos gráficos 1 e 2.
A fase tumultuosa da fermentação não é observada com as leveduras imobilizadas, provávelmente porque, presas no alginato, as leveduras não se multipliquem como em condições livres. A diminuição da massa do fermentador também é mais lenta com as leveduras imobilizadas.
Gráfico 2: Percentagem da massa inicial (Mf/Mi %) de dois fermentadores, um deles com leveduras livres e o outro com leveduras imobilizadas, monitorados uma vez ao dia, durante 19 dias
PRIMEIRA PARTE: COMO MEDIR A ACIDEZ DE UM VINAGRE?
Estima-se a concentração de ácido acético presente no vinagre por titulação ácido-base (volumetria), com fenolftaleína como indicador. Nos laboratórios de Química, a titulação se realiza com material especializado, tal como pipetas, buretas e soluções-padrão. Tais materiais dificilmente estão disponíveis, por isso, simplificamos o procedimento.
Além de utilizar uma solução de NaOH sem padronizar, substituímos as pipetas por seringas de 1 ml, as buretas, por seringas de 10 ml e os frascos de Erlenmeyer, por copos plásticos de café. Cada grupo de alunos recebe seu material, tornando-se responsáveis pela limpeza e conservação do mesmo. As seringas não precisam de agulha; ao terminar o trabalho, o material deve ser desmontado, limpo e guardado.
Adiciona-se a um volume conhecido de vinagre (V = 1 ml) uma gota de fenolftaleína, um indicador de pH, incolor em meio ácido e rosa fúcsia em meio básico. A seguir, deixa-se cair lentamente, gota a gota, uma solução de hidróxido de sódio (NaOH) de concentração conhecida CNaOH = 0,66%.
Chegará um momento em que todo o ácido acético (CH3COOH) do vinagre terá sido neutralizado pelo NaOH da solução. Esse momento é facilmente identificável. Ao adicionarmos uma gota a mais da solução de NaOH, o pH varia bruscamente e o indicador muda de cor. Isto é visível mesmo em vinagres do tipo tinto.
O volume V’ da solução de NaOH necessário para chegar ao ponto de equivalência é igual à concentração de ácido acético na amostra de vinagre. Por exemplo, se precisamos deixar cair 4 ml de uma solução de NaOH 0,66% para chegar ao ponto de equivalência, isso significa que a concentração de ácido acético no vinagre é de 4%.
Isto porque, no ponto de equivalência, o número de moles de NaOH é igual ao número de moles de CH3COOH.
OBJETIVO
Medir a concentração de ácido acético do vinagre utilizando um método simplificado de titulação volumétrica.
Observação: Em muitos países, a legislação determina que um produto só pode ser chamado de vinagre quando resulta de uma fermentação e apresenta uma concentração de ácido acético superior a 4%.
MATERIAL
Para cada grupo: Vinagre comercial, solução de fenolftaleína (1%), solução de hidróxido de sódio NaOH (0,66%), 3 copinhos pequenos de plástico (50 ml), 1 seringa de 1 ml, 1 seringa de 10 ml (ambas sem agulhas). Seringas podem ser substituídas por pipetas.
Solução de hidróxido de sódio 0,66%
Pesar 6,6 g de hidróxido de sódio (seco); dissolvê-lo em água e avolumar a solução a 1 litro. Convém preparar com antecedência uma boa quantidade de solução de hidróxido de sódio, pois como ele é higroscópico, poderá haver variações entre duas soluções preparadas em diferentes momentos.
Solução de fenolftaleína
Dissolver 1 g de fenolftaleína em 50 ml de etanol e adicionar 50 ml de água. É preferível, mas não indispensável, utilizar água destilada.
PROCEDIMENTO
1. Verter 1 ml de vinagre no primeiro copinho.
2. Acrescentar 1 gota da solução de fenolftaleína.
3. Extrair com a seringa 10 ml da solução de NAOH 0,66%.
4. Deixar cair a solução de NaOH, gota a gota, mexendo o copo para misturar os líquidos até obter uma mudança de cor persistente. O volume de NaOH vertido indica a percentagem de ácido acético no vinagre.
5. Repetir o procedimento nos outros dois copinhos.
6. Fazer a média das 3 medidas. Com a prática, as medidas costumam ser iguais.
SEGUNDA PARTE: A OBTENÇÃO DO "VINAGRE FORTE"
A obtenção de vinagre forte, um caldo com bactérias acéticas, é um passo importante na produção de vinagres. Pode-se conseguir de um produtor de vinagre ou partir para a preparação de um vinagre artesanal. Contudo, o método que aqui apresentamos tem dado bons resultados.
OBJETIVO
Obter uma cultura rica em bactérias acéticas, em quantidade adequada às nossas necessidades.
MATERIAIS
Recipiente de plástico ou de vidro de 500 ml, pano, elásticos, 4-6 uvas bem maduras, vinho tinto ou branco, 200 ml de vinagre comercial tinto ou branco, isopor e palitos para a jangada, material para a titulação como indicado na primeira parte deste guia.
PROCEDIMENTO
1. Colocar as uvas cortadas e sem as sementes em uma mistura de 100 ml de vinho e 100 ml de vinagre. Medir a acidez (acidez inicial).
2. Cobrir o copo com um pano ajustado com um elástico, para impedir a entrada de insetos.
3. Observar, dias mais tarde, o desprendimento de um cheiro ácido acentuado. Aguardar duas ou três semanas até que se forme na superfície uma camada gelatinosa que é a mãe do vinagre.
4. Controlando a acidez, que não deve baixar nunca de 3%, acrescentar semanalmente pequenas quantidades de vinho para ir amplificando o cultivo ou vinagre forte.
5. Quando for necessário, substituir o recipiente por outro maior, acrescentando uma jangada de sustentação para a zoogleia, vinagre-mãe ou mãe do vinagre.
Figura: O vinagre-mãe ou vinagre forte.
Montagem inicial.
A: jangada de isopor e palitos; B: zoogleia presa na jangada; C e D: a zoogleia, já liberada da jangada, se apresenta como uma massa gelatinosa, E: vista lateral do caldo e da zoogleia.
NOSSO COMENTÁRIO
Na superfície do caldo aparece uma película translúcida que cresce até transformar-se em uma espessa camada gelatinosa, a mãe do vinagre. Trata-se de um polímero de celulose produzido pelas bactérias acéticas e que as mantém na superfície do líquido, em contato com o ar e o substrato alcoólico. Embora tradicionalmente considerada uma zoogleia, desde o ponto de vista microbiológico, a mãe do vinagre deve ser vista como um biofilme.
À medida que o tempo passa, a mãe do vinagre se espessa cada vez mais, até, finalmente, afundar no líquido. Em pouco tempo, forma-se na superfície uma camada nova. As camadas velhas precisam ser retiradas para evitar sua decomposição, o que daria ao vinagre um odor e um sabor desagradáveis. Evita-se o problema colocando uma jangada ou balsa de sustentação na superfície do líquido. Uma das montagens mais simples utiliza metades de bolinhas de isopor e palitos.
COMO MONTAR UM PROJETO
Modificar as condições do experimento: variedade de uva, vinho tinto ou branco, vinagre tinto ou branco etc.
05. O PROCESSO LENTO DE PRODUÇÃO DE VINAGRE
O vinagre é uma bebida que contém ácido acético em uma concentração de 5-6%, resultado de uma fermentação alcoólica seguida de uma fermentação acética durante a qual o etanol é oxidado em ácido acético, por um agente biológico, em uma reação exotérmica.
Os processos de fabricação de vinagre realizam-se tanto de maneira descontinua, como de maneira semicontínua. No primeiro caso, ao alcançar as características de acidez desejadas, retira-se todo o vinagre produzido e começa-se de novo. No segundo, ao chegar a uma determinada acidez, retira-se parte do produto e adiciona-se uma quantidade equivalente de matéria-prima.
O processo lento (francês ou d’Orléans) é o método mais antigo de fabricação de vinagre. Em um barril de carvalho de 200 litros, como esquematizado na figura ao lado, se coloca o vinho até ocupar três quartos de sua capacidade.
Na superfície, em contato simultâneo com o ar e o vinho, forma-se uma película gelatinosa de Acetobacter, que é a chamada de mãe do vinagre. Um suporte quadriculado de madeira a impede de afundar no líquido (figura ao lado). A acetificação ocorre na superfície, com aeração natural. Além de lento, o processo exige espaço e tem uma produtividade muito baixa. No entanto, proporciona os melhores vinagres.
OBJETIVO
Produzir vinagre mediante o processo francês (lento).
MATERIAIS
Uma caixa de plástico, 1 jangada de isopor e linha de náilon, 1 pano de algodão, barbante ou elástico de algodão, material para a titulação como detalhado no Guia 32 (Fermentação acética: como titular o ácido acético), vinho (teor alcoólico 12 a 14 graus GL) e vinagre forte (acidez 7% a 8%), preparado em quantidade suficiente.
PROCEDIMENTO
1. Preparar o caldo misturando vinho e vinagre forte (proporção 1:3) e medir a acidez inicial (Ai).
2. Montar o fermentador, colocar a jangada e fechá-lo com o pano, ajustando-o bem a fim de evitar a entrada de insetos.
3. Medir semanalmente a acidez até que fique estável (Acidez final: Af).
4. Analisar os dados:
- Calcular o volume de etanol em 100 ml de caldo, no início da produção.
- A massa específica do etanol é de 0,78 g/ml. Calcular quantos gramas de etanol (Ei) havia em 100 ml de caldo, no início da produção.
- Calcula-se que 1 g de etanol pode originar 1,304 g de ácido acético. Justificar esta afirmação, sabendo que a equação da fermentação acética é:
CH3CH2OH + O2 --> CH3COOH + H2O
d.Calcular o rendimento do processo, que expressa a relação entre a quantidade de ácido acético obtido e a quantidade de ácido acético esperado. Seu valor se calcula mediante a fórmula
R% = 100 (Af – Ai) / (Ei x 1,304)
Rendimento e produtividade
O rendimento esperado da fermentação acética pode ser calculado a partir da relação estequiométrica segundo a qual 40 g de etanol podem ser transformados em 60 g de ácido acético, ou seja, 1 g de etanol gera 1,304 g de ácido acético.
C2H5OH + O2 --> CH3COOH + H2O
40 g 60 g
Na indústria, considera-se aceitável a transformação de 1 g de etanol em 1 g de ácido acético, correspondendo a um rendimento de 76,7%, valor que expressa a percentagem entre o ácido acético formado e o ácido acético que poderia ter sido formado. Na prática, calculamos o rendimento como no exemplo que segue.
Exemplo: Colocamos no fermentador 750 ml de vinho e 750 ml de uma mistura de vinagre e vinagre forte, obtendo uma acidez inicial de 3%. Se o teor alcoólico do vinho for de 120 GL, podemos dizer que introduzimos 12 x 750 /100 = 90 ml de etanol.
Dado que a massa específica do etanol é de 0,78 g/ml, esse volume corresponde a 70,2 g de etanol. Sendo o volume total do fermentador igual a 1.500 ml, calculamos o etanol % (m/v) inicial segundo a fórmula:
Ei % = 70,2g x 100 ml / 1.500 ml
ou seja que Ei % = 4,7%
Cinco semanas depois, ao medir novamente a acidez, encontramos o valor Af = 7%
Calculamos o rendimento, aplicando a fórmula:
R% = 100 (Af – Ai) / (Ei x 1,304)
R% = 100 (7 - 3) / 4,7 x 1,304
R% = 65,3%
A produtividade se expressa como a quantidade de ácido acético formado, em gramas/litro x hora.
Neste caso, a diferença entre Af e Ai é de 4%, ou seja, em 100 ml de caldo se formaram 4 g de ácido acético. Considerando o volume total de caldo, a quantidade de ácido acético formado é de
4 g x 1.500 ml / 100 ml = 60,
que correspondem a uma produção de
60 g / 1,5 l = 40 g/l
Por conseguinte, a produtividade do fermentador ao longo de 5 semanas, ou 840 horas, foi de 0,0476 g/l.h
Problemas possíveis
Algumas vezes, depois de atingir seu valor máximo e estabilizar-se, a acidez começa a diminuir. Isto ocorre porque, ao desaparecer o etanol do meio, algumas bactérias acéticas (Gluconobacter) passam a utilizar o ácido acético como nutriente. Tanto o processamento do vinagre como as adições periódicas de vinho resolvem o problema.
Excesso de nutrientes e pouca acidez favorecem o crescimento de Acetobacter xylinum, uma espécie que produz grandes quantidades da mãe do vinagre, chegando a obstruir os dutos do fermentador rápido. Também pode haver crescimento da população de bactérias lácticas, que dão ao vinagre um odor estranho e bastante desagradável. Não tem solução; joga-se tudo no lixo e começa-se novamente.
NOSSO COMENTÁRIO
O caldo se compõe de vinho e vinagre forte, que é um vinagre com bactérias vivas. Se a quantidade de vinagre forte disponível for pouca, pode-se complementar com um pouco de vinagre comercial. Uma regra deve ser respeitada: o caldo deve ter 5-8% de teor alcoólico e 2-3% de acidez. Concentrações mais altas de etanol são tóxicas para a flora bacteriana que ainda não está adaptada ao meio, e concentrações baixas de acidez favorecem as contaminações.
Tanto o vinho comercial como os vinhos de frutas feitos pelos alunos deram excelentes vinagres com boa acidez. Uma vez pasteurizados e acondicionados foram um dos sucessos da exposição montada na SNCT 2013.
Figura1: Variação da acidez ao longo do tempo (vinagre de vinho)
COMO MONTAR UM PROJETO
Uma vez estabilizado o fermentador, três caminhos são possíveis:
- Adicionar vinho no fermentador, visando o aumento da produção.
- Processar, engarrafar e pasteurizar o vinagre formado no fermentador, visando representar um sistema de produção descontínua, em bateladas.
- Retirar parte do vinagre (não mais de 10%) e adicionar no fermentador uma quantidade equivalente de vinho, visando representar um processo de produção semicontínuo. Chega um momento em que a zoogleia, espessa demais, precisa ser retirada.
06. COMO MONTAR UM GERADOR PARA A ACETIFICAÇÃO
O vinagre é uma bebida que contém ácido acético em uma concentração de 5-6% e resulta de uma fermentação alcoólica seguida de uma fermentação acética durante a qual o etanol é oxidado a ácido acético, em uma reação exotérmica, por um agente biológico.
Os processos de fabricação de vinagre realizam-se quer de maneira descontinua, quer de maneira semicontínua. No primeiro caso, ao alcançar as características de acidez desejadas, se retira todo o vinagre produzido e se começa de novo. No segundo, ao chegar a uma determinada acidez, retira-se parte do produto e adiciona-se uma quantidade equivalente de matéria-prima.
No processo rápido (Schuetzenbach ou alemão), o gerador ou fermentador é um recipiente de 100 a 100.000 litros de capacidade preenchidos com serragem ou outro material que tenha uma superfície de contato grande e sobre a qual se fixam as bactérias acéticas.
O vinho circula repetidas vezes no gerador enquanto se injeta ar no sentido contrário. O calor não se espalha tão facilmente como no método tradicional, e é necessário, então, um método de esfriamento, estabelecendo um gradiente de temperatura que impulsiona a circulação do ar. Em relação ao processo lento, a produtividade é maior, mas a qualidade do vinagre é inferior.
A partir de 1950, desenvolveram-se sistemas de produção nos quais as bactérias estão submersas em uma mistura hidroalcoólica, dentro de enormes cubas de aço inoxidável. Estes acetificadores modernos contam com agitação, oxigenação e controles de temperatura. Desenhados e patenteados pela empresa alemã Heinrich Frings, os geradores ou Acetators são utilizados em mais de 50 países. Produzem 920 a 960 litros de vinagre com 10% de acidez a partir de 100 litros de álcool absoluto e funcionam em turnos de 24 horas. Devido a sua eficiência, também são utilizados na produção de ácido acético para outras finalidades.
No processo rápido (Schuetzenbach ou alemão) o caldo e o ar circulam sobre as bactérias acéticas previamente fixadas a um suporte, condições que podem ser obtidas, no laboratório de ensino, com materiais simples e de baixo custo. Para construir o gerador - ou fermentador - utilizamos garrafas plásticas, evitando aquelas com desenhos ou relevos porque deixam buracos por onde entram as moscas. Uma bomba de aquário injeta ar pela mangueira que conecta a parte inferior à parte superior do fermentador, garantindo o fornecimento de oxigênio e impulsionando a circulação do líquido.
OBJETIVO: Montar um gerador para a produção de vinagre (Processo rápido)
MATERIAIS
Garrafas plásticas, algodão, tesouras para cortar as garrafas, 1 prego para furá-las, mangueira de aquário, mangueira de látex, bomba de aquário, agulha de injeção, fósforos
PROCEDIMENTO
- Conectar o sistema de circulação do ar (bomba de aquário)
- Manter o gerador em observação por vários dias, verificando a circulação de ar e de líquido.
NOSSO COMENTÁRIO
Dois problemas surgem com alguma frequência. Um deles surge quando a bomba de aquário é colocada a uma altura menor que a do líquido presente na parte inferior do fermentador. Em caso de corte de energia, o líquido entra na bomba, inutilizando-a. O segundo é o refluxo de ar rumo ao fermentador, porque o líquido deixa de circular e a falta de nutrientes é prejudicial para as bactérias acéticas que estão nas aparas, no compartimento superior.
Evita-se o refluxo deixando um pedaço bastante comprido de mangueira entre a saída do fermentador e a agulha de injeção. Porém, se houver refluxo, deve-se restabelecer rapidamente a circulação. Um método simples de fazê-lo consiste em apertar a mangueira de látex antes do lugar onde está inserida a agulha até a chegada do líquido e soltar.
Uma vez construído o gerador ou fermentador e contando com um volume razoável de vinagre forte, o desafio consiste em colocar em funcionamento um gerador que permita reproduzir as condições características do processo rápido de produção de vinagre.
OBJETIVO
Produzir vinagre mediante o processo rápido.
MATERIAIS
Material para titulação, vinagre forte, gerador, vinagre comercial e aparas de madeira, lavadas e fervidas.
PROCEDIMENTO
1. Inoculação das aparas de madeira
Submergir as aparas em uma mistura de vinagre forte (acidez 7%) e vinho na proporção 3:1. Uma parte do vinagre forte pode ser substituída por vinagre comercial. Depois de 2 a 4 semanas, se observa uma película fina e brilhante sobre a madeira, indicando a fixação das bactérias no suporte.
2. Entrada em ritmo de produção
a. Montar o fermentador e verificar seu funcionamento.
b. Desmontar o fermentador.
Colocar o caldo (vinagre forte e vinho, proporção 3:1) na garrafa 1 e as aparas inoculadas na garrafa 2. Montar novamente o fermentador e iniciar a circulação do caldo até observar, depois de 2 ou 3 dias, que a garrafa 2 embaça levemente. O fermentador estará pronto para entrar em ritmo de produção.
c. Monitorar a acidez do caldo como indicado no Guia 04 e, quando esta for suficientemente alta (7 – 10%), retirar uma parte do caldo e acrescentar um volume equivalente de vinho.
Em momento algum do processo, o teor alcoólico deve ser inferior a 5-8% nem a acidez menor a 4%. O vinagre produzido pode ser filtrado, engarrafado e pasteurizado (65 graus Celsius, 5 minutos).
NOSSO COMENTÁRIO
Montamos um sistema simples no qual o vinho circula repetidas vezes sobre um suporte (aparas de madeira) onde as bactérias acéticas estão aderidas. O monitoramento da acetificação mostrou que a acidez diminui quando se retira vinagre e se acrescenta vinho, o que pode ser verificado no gráfico abaixo. Os valores registrados nos dias 5, 8, 11 e 15 correspondem às medidas tomadas antes e depois de retirar 500 ml de vinagre e colocar 500 ml de vinho.
Gráfico : Acidez do vinagre ao longo da acetificação (Processo rápido)
COMO MONTAR UM PROJETO
- Substituir as aparas de madeira por outros materiais: isopor, bagaço de cana-de-açúcar, de uva ou de maçã, cerâmica, pedras etc.
- Comparar a produção de dois fermentadores, considerando quanto vinagre a 4% se consegue a partir do volume de vinagre forte retirado por semana.
- Comparar a produtividade de dois fermentadores, considerando o valor gramas/litro x hora.
08. PRODUÇÃO DE BIOMASSA DE SPIRULINA (Arthrospira)
OBJETIVO: produzir biomassa de microalgas, cultivando uma cianobactéria (Arthrospira) em um biorreator.
Observação: Arthrospira costuma ser vendida nos produtos comerciais com o nome de Spirulina.
MATERIAL
Fermentação: Inóculo de Arthrospira, fermentador, meio de cultivo, termômetro, medidor ou papel indicador de pH, provetas, pipetas, microscópio, lâminas e lamínulas.
Medidas de turbidimetria: espectrofoômetro (570 nm) ou medidor de concentração, pipetas graduadas.
Obtenção da massa seca (mg): bomba de vácuo, Kitasato, funil de Buchner, papel de filtro, placa de Petri, forno ou estufa, balança.
Meio de cultivo: Zarrouk (adaptado) para o cultivo de Arthrospira (Spirulina)
Reagentes
Água Destilada; K2HPO4 = 0,5 g/l; NaNO3 = 2,5 g/l; K2SO4 = 1,0 g/l; NaCl = 1,0 g /l; CaCl2 = 0,04 g/l; MgSO4 . 7H2O = 0,2 g/l; EDTA = 0,08 g/l; FeSO4 . 7 H2O = 0,01 g/l; 2 gotas de Ouro Verde ou de Biofértil; NaHCO3 = 16,8 g/l.
Preparação
1. Avolumar 750 ml de água destilada;
2. Pesar 0,5g de K2HPO4, 2,5g NaNO3, 1,0g K2SO4, 1,0g NaCl, 0,2g MgSO4.7H2O, 0,4g CaCl2, 0,8 g EDTA, 0,1g FeSO4 . 7 H2O, 16,8 g de NaHCO3 (este será adicionado por último);
3. Com o auxilio de um agitador magnético adicionar UM a UM os reagentes K2HPO4, NaNO3, K2SO4, NaCl, MgSO4.7H2O aos 750ml de água destilada. Atenção, misturar bem e aguardar até um reagente dissolver antes de adicionar o seguinte; cuidado com o K2HPO4 e o MgSO4.7H2O (há risco de precipitação).
4. Preparar solução mãe de CaCl2 (0,4g – 100ml), recolher uma alíquota de 10 ml e adicionar aos 750ml de água destilada;
5. Preparar solução mãe de EDTA (0,8g – 100ml), recolher uma alíquota de 10 ml e adicionar aos 750ml de água destilada;
6. Preparar solução mãe de FeSO4 (0,1g – 100ml), recolher uma alíquota de 10 ml e adicionar aos 750ml de água destilada;
7. Adicionar 2 gotas de Ouro Verde ou de Biofértil;
8. Finalmente, adicionar as 16,8g de NaHCO3 e, se for necessário, com o auxílio de uma solução de NaOH 0,1N ajustar o pH a 10.
9. Completar a solução a 1 litro e esterilizá-la.
PROCEDIMENTO
- Desenho do biorreator. Qual o volume ideal para este trabalho?
- Preparação do meio e escolha das condições de cultivo de Arthrospira
- Montagem do biorreator e inicio do cultivo de Arthrospira. Acompanhar semanalmente o processo mantendo o pH entre 10 e 11. Verificar microscopicamente a pureza da cultura.
- Monitoramento do crescimento populacional. Extrair semanalmente uma alíquota do meio e colocar a cultura no turbidímetro, no espectrofotômetro ou, eventualmente, no medidor de concentração caseiro até não observar mais a luz. Medir o volume de cultura utilizado e registrar o valor em uma tabela.
5. Separação da massa seca, quando a concentração fica estacionária.
a. Separar a Arthrospira por filtração à vácuo e colocar a secar na estufa.
b. Qual a quantidade de massa seca obtida?
As imagens mostram a montagem dos fermentadores no laboratório, a filtração do cultivo e os painéis sobre o cultivo de Arthrospira realizado por Gabriel Politzer Couto, Guilherme Fagundes Pagotto e Luiza Vetorazzo Amaral, alunos do Segundo ano do Curso Técnico de Biotecnologia (Nível Médio), apresentados na SNCT 2009. O acompanhamento dos cultivos foi feito por espectrofotometria a 570nm.
NOSSO COMENTÁRIO
A maior dificuldade está na preparação do meio.
O melhor método para avaliar a turbidez do meio e o crescimento de Arthrospira é a espectrofotometria. Contudo, no laboratório, quando vários grupos de alunos desenvolvem o seu cultivo de Arthrospira (Spirulina), o espectrofotômetro disponível sofre um engarrafamento de alunos com a conseguinte perda de tempo. Em função dessa limitação utilizamos nas aulas práticas métodos mais simples, disponíveis para todos a qualquer momento.
Medidores caseiros nos permitiram acompanhar o crescimento dos cultivos de Arthrospira. Um modelo foi o da Global Learning and Observations to Benefit the Environment (GLOBE), que figura ao lado, e que adaptamos como a seguir.
O disco de base é fixado (com plástico transparente e um elástico de borracha) na base de um tubo opaco de 40 cm de comprimento e colocado sobre uma fonte difusa de luz.
O cultivo é adicionado lentamente com uma pipeta graduada. O volume de cultivo acrescentado até deixar de ver o fundo pode ser considerada uma estimativa da densidade populacional. Os valores obtidos ao longo do tempo são uma estimativa do crescimento de Arthrospira.
BIBLIOGRAFIA
LOURENÇO S.O. Cultivo de microalgas marinhas: Princípios e aplicações. São Carlos, RiMa Editora, 2006
NOSSO AGRADECIMENTO Ao Dr. Sergio de Oliveira Lourenço que nos forneceu o inóculo de Arthrospira (Spirulina)
Fatos tão diversos e assustadores quanto as luzes dos cemitérios, o gás dos pântanos ou as explosões nas galerias das minas de carvão têm uma explicação comum: a produção de gás combustível por ação bacteriana a partir de resíduos orgânicos. A partir do conhecimento deste processo natural tem-se desenvolvido uma tecnologia (= biodigestão anaeróbia) para a obtenção de biogás a partir de lixo. Nem sempre o processo resulta econômico. Porém, uma visão integrada possibilita a utilização de outros subprodutos formados, abrindo-se novas perspectivas para uma “velha” tecnologia.
OBJETIVO: produzir biogás
MATERIAL
Garrafas plásticas, conexões, rolhas, banho a 55 graus Celsius, lixo doméstico ou lixo artificial, água, Ca(OH)2, NaOH, papel pH, detergente, vela, fósforos.
Composição do lixo artificial (OECD)
Diluir em 1 litro de água: 160 mg de peptona, 30 mg de ureia, 110 mg de extrato de carne, 7 mg de cloreto de sódio, 4 mg de cloreto de cálcio (CaCl2.2H2O), 2 mg de sulfato de magnésio (Mg2SO4.7H20), 28 mg de fosfato ácido de potássio (K2HPO4). Pode-se acrescentar acetato de sódio 1% (massa/volume).
PROCEDIMENTO
1. Em uma garrafa plástica, misturar 500 ml de lixo (feijão ou restos de alimentos + húmus de minhoca ou lodo + lixo sintético) e água na proporção igual.
2. Acrescentar 1 g de glicose.
3. Medir o pH; se for necessário corrigir com NaOH ate 7,6.
4. Montar o experimento intercalando uma garrafa com Ca(OH)2, como indicado no esquema.
5. Manter a garrafa com resíduos orgânicos a 55° C.
6. Depois de 14 dias, testar a presença de biogás. Como?
NOSSO COMENTÁRIO
Encontramos algumas dificuldades. Em um dos primeiros testes, a matéria orgânica entupiu a mangueira de saída do gás gerando uma explosão que sujou até o teto do laboratório. Recomenda-se não encher a garrafa mais que até a metade.
Em alguma ocasião a reação parou. Problemas com o pH?
A identificação do gás recolhido como biogás pode ser feita por combustão. Como todo cuidado é pouco, uma garrafa fechada com o gás recolhido foi imersa em uma cuba com água e umas gotas de detergente. Abrimos lentamente a garrafa debaixo da água aproximando um vela acessa às bolhas formadas na superfície. A altura e intensidade da chama confirmaram a presença de um gás combustível (biogás). Todo cuidado é pouco!
O biodiesel é um combustível composto por ésteres produzidos na reação química de transesterificação. Esta ocorre entre óleos vegetais e álcool (etanol ou metanol), em presença de um catalisador inorgânico (Figura 1) ou enzimático. Deixa como subproduto o glicerol (5 a 10% do produto bruto), que é aproveitado por algumas indústrias (alimentos, cosmética, medicamentos).
Figura 1: A reação de transesterificação.
Trata-se de uma transesterificação de triacilgliceróis (triglicerídeos), na qual R representa a cadeia carbônica dos ácidos graxos e R’, a cadeia carbônica do álcool reagente
O biodiesel fornece entre 88 e 95% da energia do diesel, mas quando misturado com o diesel convencional (B1 com 1% de biodiesel a B20 com 20% de biodiesel) aumenta a qualidade do combustível, diminuindo a emissão de partículas poluentes e gases tóxicos na atmosfera.
A produção de biodiesel está localizada principalmente na União Europeia (60%) e, em menor parte, nos Estados Unidos, na China, na Indonésia e na Malásia. Do ponto de vista energético, os sistemas produtivos mais eficientes seriam os associados aos complexos agroindustriais (soja, milho, girassol), embora apresentem o grave defeito de desviar para a produção de energia as matérias-primas de alimentos e rações. A matéria-prima é variada: soja nos Estados Unidos, canola na União Europeia e no Canadá, soja e girassol na Argentina, dendê na Ásia. No Brasil, tem-se experimentado soja, mamona, babaçu, dendê, girassol, milho, amendoim, pinhão-manso etc.
OBJETIVO
Preparar biodiesel via uma reação química de transesterificação.
MATERIAIS
Balança, bastão de vidro, água destilada, erlenmeyer, pipeta de 1 ml, pipeta de 10 ml, peras adequadas, proveta de 100 ml, óleo de soja, 15 ml de metanol, 1 ml de uma solução de KOH 9M, funil de decantação, suporte universal, argola, nozes, colher, bico de Bunsen, béquer.
SEGURANÇA
Cuidado! Utilizar jaleco e óculos de segurança. O metanol é inflamável e venenoso. Deve ser adicionado na capela de exaustão.O hidróxido de potássio é corrosivo. O excesso deve ser neutralizado com ácido clorídrico 3M antes de ser despejado no ralo e deixar correr muita água.
PROCEDIMENTO
Preparação de biodiesel
1. Colocar em um erlenmeyer 100 ml de óleo vegetal.
2. Adicionar, cuidadosamente, 15 ml de metanol.
3. Acrescentar vagarosamente 1 ml da solução de KOH 9M.
4. Agitar a mistura por 10 minutos.
5. Colocar no funil e aguardar a decantação.
6. Retirar a camada inferior.
7. Lavar a camada superior com 10 ml de água destilada e deixar decantar novamente. A camada superior é o biodiesel.
8. Medir a quantidade de biodiesel obtida e calcular o rendimento relativo à quantidade de óleo vegetal utilizada.
9. Calcular o rendimento do processo, sabendo que 1.200 kg de óleo vegetal produzem 1.100 kg de biodiesel cru.
Teste de combustão
Este teste é realizado colocando 2 ml de combustível em uma colher presa a um suporte universal e aquecendo com o bico de Bunsen até inflamar. A diferença observada entre a combustão do óleo vegetal utilizado como matéria-prima e do produto obtido na reação de transesterificação sugere que realmente se obteve biodiesel.
NOSSO COMENTÁRIO
Em ocasião da SNCT (2005) os alunos prepararam biodiesel a partir do óleo usado para fritar batata, cedido gentilmente pela concessionária da cantina (Figura 2).
Obtiveram-se 95 ml de biodiesel (massa = 76,5 g) a partir de 100 ml de óleo vegetal (massa = 89,3 g), o que significa um rendimento de 85,67%. Segundo a bibliografia citada, 1.200 kg de óleo vegetal produzem 1.100 kg de biodiesel cru, de modo que o rendimento esperado era de 91,7%. Apesar de inferior, os alunos consideraram o rendimento do experimento como sendo muito satisfatório.
No teste de combustão, o produto apresentou-se inflamável, indicando que o material realmente é um combustível. A chama obtida com o produto era visivelmente diferente da obtida com o óleo.
Figura 3: Alguns momentos da preparação de biodiesel (SNCT, 2005): Separação das camadas, decantação e teste de combustão
COMO MONTAR UM PROJETO
Devido aos cuidados requeridos de segurança, devem-se avaliar muito bem as condições de trabalho e o nível dos alunos antes de montar qualquer projeto.
BIBLIOGRAFÍA
WMRC. GREEN CHEMISTRY LESSONS: Biodiesel – Using renewable resources.
11. MICRORGANISMOS PRODUTORES DE ENZIMAS
As fontes mais frequentes de microrganismos são o solo e a lama de lagos e rios: um grama de solo pode conter até 10 bilhões de microrganismos. A coleta de microrganismos em ambientes naturais e seu cultivo em diversos meios de enriquecimento seletivos possibilita a seleção de linhagens diversas, produtoras de enzimas, metabólitos diversos, antibióticos etc. Algumas dessas linhagens, constituem os denominados microrganismos industriais que podem ser adquiridos como linhagens puras, geneticamente estáveis e aptas para o cultivo em grande escala, em Bancos e Coleções de Cultura.
Ainda existem muitas expectativas em relação à prospecção de linhagens microbianas para a indústria. Os avanços na área da genômica contribuem para ampliar nosso conhecimento das comunidades microbianas do ambiente.
PRIMEIRA PARTE: PRODUTORES DE AMILASES
OBJETIVO
Identificar microrganismos produtores de amilases, em um ambiente natural.
MATERIAIS
1 espátula, 1 tubo de diluição com 5 mL de solução salina estéril ou com água destilada, 1 placa com meio ágar-amido, 1 swab, solução de Lugol, 1 pipeta, formol, fita adesiva.
PROCEDIMENTO
1. Colher uma ponta de espátula de terra e transferi-la ao tubo de diluição. Misturar bem.
2. Molhar o swab na suspensão de terra e espalhar o líquido na superfície do ágar nutriente, formando um tapete.
3. Fechar a placa com um pedacinho de fita adesiva.
4. Incubar a temperatura ambiente até visualizar o crescimento microbiano.
5. Dado que nesta etapa é praticamente impossível identificar a presença ou ausência de patógenos, antes de proceder ao próximo item se recomenda inverter a placa, colocar umas gotas de formol na tampa e deixar por 24 horas antes de abrir a placa. O isolamento de linhagens só pode ser realizado por pessoas treinadas, em laboratórios adequados.
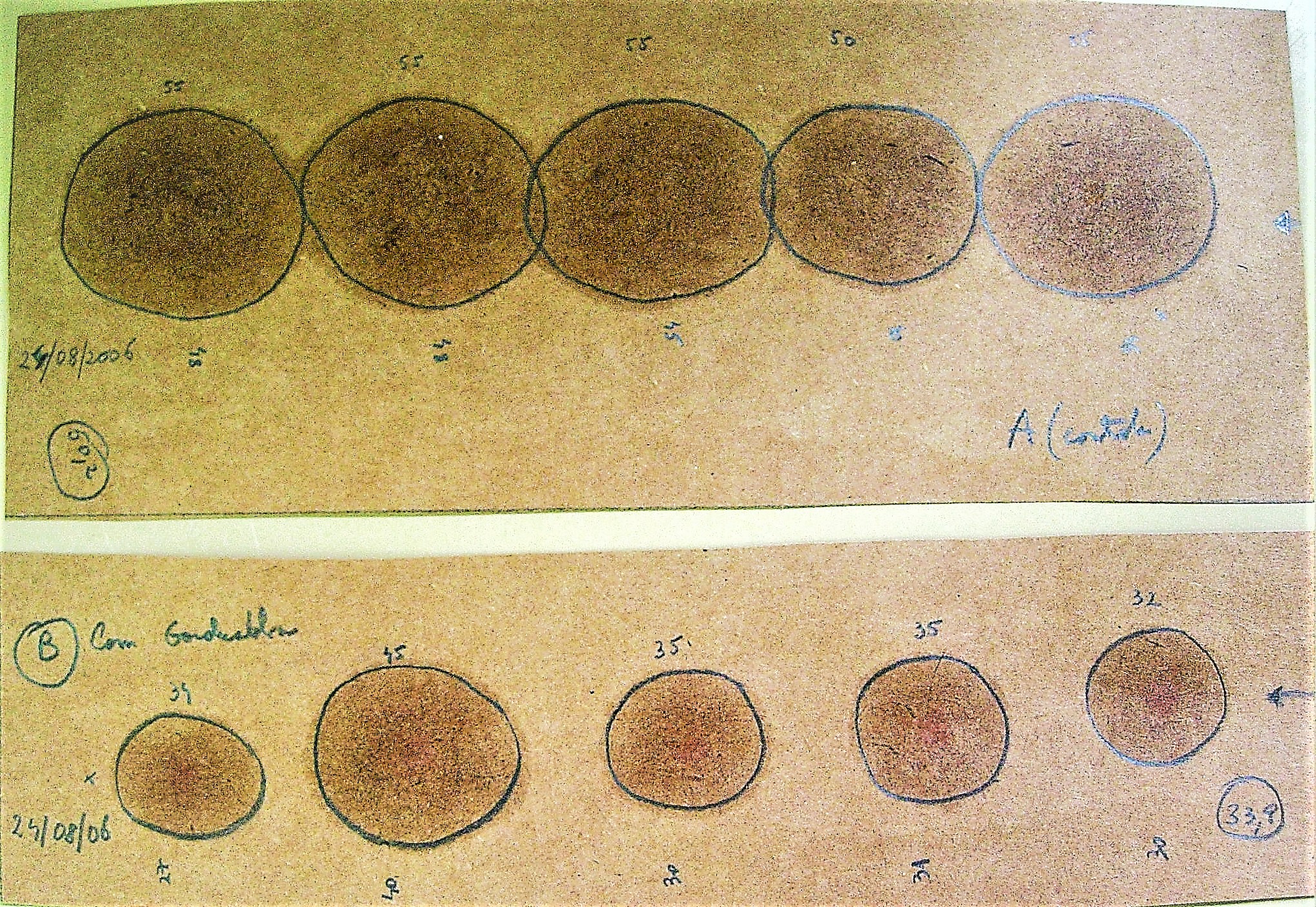
6. Abrir a placa e colocar a solução de Lugol na superfície do meio. No lugar onde cresceram microrganismos produtores de amilases se formará um halo incolor, no lugar onde o amido não foi digerido o ágar toma uma coloração azul característica.
NOSSO COMENTÁRIO
Esta atividade tem sido desenvolvida em campo, dando aos alunos a possibilidade de analisar as características do ambiente, antes de escolher o lugar onde será colhida sua amostra.
Figura: Microrganismos produtores de amilases: Placa controle (amido + lugol) com coloração azul , placa com microrganismos produtores de amilases, em diferente iluminação. O meio fica transparente em redor das colônias de microrganismos produtores de amilases.
SEGUNDA PARTE: PRODUTORES DE PROTEASES
OBJETIVO
Identificar microrganismos produtores de proteases, em um ambiente natural.
MATERIAIS
1 espátula, 1 tubo de diluição com 5 mL de solução salina estéril ou com água destilada, 1 placa com meio ágar-leite, 1 swab, 1 pipeta, formol, fita adesiva.
PROCEDIMENTO
1. Colher uma ponta de espátula de terra e transferi-la ao tubo de diluição. Misturar bem.
2. Molhar o swab na suspensão de terra e espalhar o líquido na superfície do ágar nutriente, formando um tapete.
3. Fechar a placa com um pedacinho de fita adesiva. As placas não devem ser abertas a menos de contar com pessoal treinado e condições laboratoriais adequadas, porque não é possível assegurar a ausência de patógenos.
4. Incubar a temperatura ambiente até visualizar o crescimento microbiano.
5. No lugar onde cresceram microrganismos produtores de proteases se visualizará um halo incolor, no lugar onde a proteína não foi digerida o ágar permanece branco opaco.
NOSSO COMENTÁRIO
Esta atividade tem sido desenvolvida em campo, dando aos alunos a possibilidade de analisar as características do ambiente, antes de escolher o lugar onde será colhida sua amostra.
A figura mostra uma placa com meio ágar-leite semeada com microrganismos do solo de Petrópolis. A produção de proteases é evidenciada pela presença de um halo transparente em redor das colônias.
Figura: Microrganismos produtores de proteases.
COMO MONTAR UM PROJETO
Utilizando as técnicas apresentadas, pesquisar a presença de microrganismos produtores de amilases e/ou de proteases em diversos ambientes.
TERCEIRA PARTE: PRODUTORES DE CELULASES
A identificação e seleção de microrganismos produtores de celulases pode ser realizada seguindo um procedimento análogo ao seguido na primeira parte deste guia para os produtores de amilases.
O meio adequado é ágar-carboximetilcelulose e os halos em redor das colônias produtoras de celulases pode ser evidenciado com vermelho-Congo (cuidado, é tóxico) ou com iodo de Gram.
QUARTA PARTE: COMPLEMENTOS TÉCNICOS
MEIO DE AGAR-AMIDO
Preparação de uma goma de amido a 1%
1. Diluir 1 g de amido em 10 ml de água fria.
2. Verter em 90 ml de água fervendo.
3. Misturar e deixar ferver por 3 minutos.
4. Resfriar.
Preparação do meio de cultivo agar-amido (100ml)
O meio de amido é também utilizado para o cultivo de fungos.
Dependendo do operador, 100 ml de meio permitem preparar entre 5 e 8 placas de Petri de 9 cm de diâmetro.
1. Preparar uma suspensão de 1,3 g de ágar em 90 mL de meio nutriente (caldo de carne). Esquentar até dissolver o ágar.
2. Acrescentar 10 mL de goma de amido a 1%, preparada como indicado anteriormente. Misturar bem.
3. Esterilizar. Deixar esfriar a uma temperatura de 60 graus Celsius, aproximadamente, antes de distribuir nas placas de Petri previamente esterilizadas.
MEIO DE METILCELULOSE
Dissolver 0,5 g de Carboxi-metil-celulose e 2 g de ágar em 200 ml de água destilada e esquentar até o meio ficar translúcido. Esterilizar e distribuir em placas de Petri.
MEIO DE AGAR-LEITE
Preparação (Para 100 mL).
Dependendo do operador, essa quantidade permite preparar entre 5 e 8 placas de Petri de 9 cm de diâmetro, dependendo do operador.
1. Dissolver 2 g de leite em pó desnatado em 10 mL de água destilada.
2. Preparar uma suspensão de 1,3 g de ágar em 90 mL de meio nutriente (caldo de carne). Esquentar até dissolver o ágar.
3. Esterilizar em recipientes separados o leite e o meio de carne.É inútil misturar o leite e o meio de carne antes de esterilizar. O desastre é garantido, porque o leite coagula.
4. Deixar esfriar a uma temperatura de 60 graus Celsius, aproximadamente.
5. Misturar o leite e o meio de carne.
6. Distribuir em condições assépticas em placas de Petri previamente esterilizadas.
REAGENTE DE LUGOL (Solução de iodo-iodeto de potássio)
Conservar em frasco de vidro âmbar ou em frasco recoberto com papel alumínio. Em experimentos simples o reativo de Lugol pode ser substituído por tintura de iodo, comprada na farmácia. Cuidado! Algumas pessoas são alérgicas ao iodo.
Solução concentrada : Dissolver 10 g de iodeto de potássio (KI) e 5 g de iodo (I2) em 50 ml de água destilada e completar a 100 ml.
Solução para a identificação de amido e para a coloração de bactérias (Lugol de Gram) : Dissolver 2 g de iodeto de potássio (KI) em 100 ml de água destilada; acrescentar 1 g de cristais de iodo e completar a 300 ml de água destilada.
Em presença do reagente de Lugol o amido adquire uma coloração azul característica. A hidrólise da molécula de amido libera dextrinas que, em presença de Lugol adquirem uma cor marrom-avermelhada.
Solução para a identificação de celulose : Dissolver 5 g de KI e 1 g de I2 em 330 ml de água. A solução tinge a celulose de cor marrom-avermelhada, que se perde por lavagem em água.
BIBLIOGRAFIA
BU’LOCK J. & KRISTIANSEN B. Basic Biotechnology. London, Academic Press,1989
MAIGAN M. ET AL. Microbiologia de Brock. São Paulo, Pearson Prentice Hall, 2004.
MORITA T., ASSUMPÇÃO ROSELY M.V. Manual de soluções, reagentes e solventes. São Paulo, Editora Edgar Blücher Ltda., 1972.
12. AS ENZIMAS NO LAVADO DAS ROUPAS
Os produtos para lavar roupa apresentam uma composição complexa. O principal agente de limpeza é um detergente (tensioativo aniônico), que movimenta e dispersa a sujeira. Contudo, há manchas muito difíceis de remover, como molhos, suor, ovo, cosméticos, terra etc. A introdução de enzimas na composição dos produtos para lavar roupa é uma forma específica, muito engenhosa, de retirar as manchas.
A indústria segue um procedimento padrão para avaliar o efeito da inclusão de uma enzima em um produto destinado à lavagem de roupa. Amostras de pano manchadas com algumas substâncias típicas (ovo, tomate, azeite) são divididas em dois grupos, um deles será lavado com um produto sem enzimas, o outro, com o mesmo produto mais a enzima correspondente. Para eliminar a subjetividade intrínseca às observações diretas, os resultados serão avaliados mediante um parâmetro físico, denominado refletância, medido por espectrofotometria. A eficiência entre os diferentes tratamentos (sem e com enzima) se expressa como a diferença entre as refletâncias obtidas em ambos os casos.
Obviamente, no âmbito educativo, não podemos reproduzir esse método. Porém, é possível realizar alguns experimentos semelhantes nos quais se avaliem os resultados por observação direta. Apesar de sua simplicidade, trata-se de experiências extremamente versáteis e motivadoras, como as propostas nas atividades seguintes.
De um modo geral, deve-se levar em conta que os resultados não são absolutos. Se hoje o produto mais eficaz é X, em um mês o competidor Y poderá superá-lo, em função de uma mudança na sua composição. Mais importante que determinar ''qual é o melhor'' é como fazê-lo: o método é mais importante que as conclusões.
PRIMEIRA PARTE: A EFICIÊNCIA DAS ENZIMAS NA REMOÇÃO DAS MANCHAS
OBJETIVO: Avaliar a eficiência das enzimas de um produto para o lavado das roupas na remoção de manchas de molho de tomate.
MATERIAIS
Uma solução do produto com enzimas para lavar roupa e outra do mesmo produto fervido durante 1 hora, ambos em uma concentração de 4 colheres das de sopa por litro.
Molho de tomate, 5 amostras de pano de algodão branco (previamente lavadas e secas), 1 molde e 1 pincel para fazer as manchas, 3 garrafas plásticas, 1 marcador, 1 folha de papel e 1 lápis.
Tratamento dos panos
1. Separar um dos panos manchados e guardar no escuro (sem tratamento, controle).
2. Rotular as 3 garrafas (água, lava-roupas biológico, lava-roupas biológico fervido) e colocar 500 ml da solução correspondente em cada uma delas.
3. Colocar um pano manchado em cada garrafa.
4. Fechar as garrafas e agitá-las, virando-as de cabeça para baixo 20 vezes.
5. Deixar de molho por 2 horas (ou até o dia seguinte).
6. Agitar novamente, virando cada garrafa de cabeça para baixo 20 vezes.
7. Enxaguar os panos, sem esfregar, mudando a água 10 vezes.
8. Retirar os panos das garrafas e, sem misturá-los, guardá-los no escuro até secar.
9. Grampear os panos em 4 fichas, indicando o tratamento correspondente (controle, água, lava-roupas, lava-roupas biológico).
10. Avaliar a intensidade das manchas em uma escala de 0 (ausência de mancha) a 5 (pano manchado, sem tratamento algum).
11. Classificar os tratamentos em ordem decrescente, em função de sua eficiência em remover as manchas de molho de tomate.
NOSSO COMENTÁRIO
Nesta atividade comparamos a eficiência de duas amostras de um produto lava-roupas, uma com enzimas e a outra fervida durante uma hora para inativar as enzimas. Um cuidado prático importante é completar o volume de água evaporada ao ferver, de modo que as concentrações dos produtos sejam iguais.
As manchas de polpa de tomate em caixinha são as mais fáceis de fazer e de analisar. Havendo vários grupos de alunos, o procedimento se amplia colocando mais panos nas mesmas garrafas e soluções. A leitura deve ser coletiva para uniformizar os critérios de avaliação.
COMO MONTAR UM PROJETO
- Estudar diferentes produtos para a lavagem de roupas.
- Testar diferentes tipos de manchas
SEGUNDA PARTE: A REMOÇÃO DE MANCHAS DIFERENTES
Numerosos produtos para lavar roupa contêm enzimas. Todos prometem remover as manchas de molho, suor, ovo, sangue, cosméticos, terra etc. Entretanto, há diferenças entre eles devidas ao tipo e à quantidade de enzimas. Muitos contêm proteases, alguns também têm amilases, lipases e/ou celulases.
OBJETIVO
Comparar a eficiência de vários produtos com enzimas na remoção de manchas de diferentes origens.
MATERIAIS
Soluções de 3 produtos com enzimas para lavar roupa e 1 sem enzimas (concentração: 4 colheres das de sopa por litro); 6 amostras de pano de algodão branco, 1 molde e 1 pincel, 3 substâncias para manchar as amostras (molho de tomate, achocolatado e batom).
Tratamento dos panos
1. Separar 1 dos panos manchados e guardar no escuro (sem tratamento, controle)
2. Rotular as garrafas (água, produto 1, produto 2, produto 3, e colocar 500 ml da solução correspondente em cada uma delas.
3. Colocar 1 pano manchado em cada garrafa.
4. Fechar as garrafas e agitá-las, virando-as de cabeça para baixo 20 vezes.
5. Deixar de molho duas horas (ou até o dia seguinte).
6. Agitar novamente, virando cada garrafa de cabeça para baixo 20 vezes.
7. Enxaguar os panos, sem esfregar, mudando a água 10 vezes.
8. Retirar os panos das garrafas e, sem misturá-los, guardá-los no escuro até secar.
9. Grampear os panos em 4 fichas, indicando o tratamento correspondente (controle, água, produto 1, produto 2, produto 3).
10. Para cada produto, avaliar a intensidade de cada tipo de mancha em uma escala de 0 (ausência de mancha) a 5 (pano manchado, sem tratamento algum). Comparar as médias obtidas com os diferentes produtos para cada tipo de mancha. Qual produto se mostrou mais eficiente?
NOSSO COMENTÁRIO
As manchas de batom devem ser feitas com uma pincelada leve, diretamente ou com um pouco de óleo de cozinha no qual se dissolveu um pouquinho do produto cosmético. Para evitar a subjetividade induzida pelas propagandas comerciais é melhor preparar as soluções com antecedência, rotulando-as como P1, P2, P3 etc, sem revelar ‘quem é quem’ até a conclusão do estudo. Os ensaios cegos fornecem resultados surpreendentes. O número de amostras pode ser calculado em função do número de grupos de alunos (3 panos por grupo, os controles podem ser os mesmos).
O valor atribuído à intensidade da mancha será a média dos valores atribuídos pelos diferentes grupos, relativos ao mesmo tipo de mancha tratada com um produto determinado, sempre que se tenham mantido constantes as demais variáveis, isto é, concentração do produto, tempo de incubação, temperatura, agitação, número de enxágues e secagem.
Exemplo: A experiência foi realizada com amostras manchadas com várias substâncias (achocolatado, batom e molho de tomate), deixadas de molho durante 4 horas. Obtiveram-se os resultados da tabela abaixo, fotografados na figura que a segue. Nas condições do experimento, nenhum produto eliminou as manchas de achocolatado e de batom. Porém, P2 e P3 foram os mais eficientes para remover manchas de molho de tomate.
Tabela: Intensidade das manchas de diferentes substâncias (achocolatado, batom, molho de tomate), após o tratamento com diferentes produtos que contêm enzimas. A imagem mostra os resultados do experimento
COMO MONTAR UM PROJETO
Substituir as manchas por outras de origens diversas: ovo, terra, grama, graxa etc.
TERCEIRA PARTE: O TEMPO DE MOLHO E A REMOÇÃO DAS MANCHAS
O desempenho de um produto para lavar roupa com enzimas varia com o tipo de mancha, mas também depende de outros fatores, tal como o tempo que se deixam as roupas de molho.
OBJETIVO
Avaliar a eficiência de um produto com enzimas (P2) sobre manchas de molho de tomate quando aumentamos o tempo de molho das amostras de pano.
MATERIAIS
Soluções de um produto (P2) para lavar roupa com enzimas e de outro (P1) sem enzimas (concentração: 4 colheres das de sopa por litro); 6 amostras de pano de algodão branco, 1 molde e 1 pincel, molho de tomate, 2 garrafas plásticas cortadas, 2 palitos para agitar, 1 marcador, 1 folha de papel e 1 lápis.
Tratamento dos panos
1. Separar um dos panos manchados e guardar no escuro (sem tratamento).
2. Rotular as 2 garrafas (produto com enzimas, produto sem enzimas) e colocar 500 ml da solução correspondente em cada uma delas.
3. Colocar 2 panos manchados em cada garrafa.
4. Fechar as garrafas e agitá-las, virando-as de cabeça para baixo 20 vezes.
5. Deixar de molho duas horas.
6. Enxaguar 1 dos panos de cada garrafa, sem esfregar e guardá-los no escuro até secar.
7. Depois de 24 horas de molho, repetir o item anterior.
8. Grampear os panos em 4 fichas, indicando o tratamento correspondente (produto e tempo de molho).
9. Avaliar a intensidade das manchas em uma escala de 0 (ausência de mancha) a 5 (pano manchado, sem tratamento algum). Comparar os diferentes tratamentos e concluir.
NOSSO COMENTÁRIO
As manchas de polpa de tomate em caixinha são fáceis de fazer e de analisar. Havendo vários grupos de alunos, o procedimento se amplia, colocando mais panos nas mesmas garrafas e soluções. A leitura deve ser coletiva para uniformizar os critérios de avaliação.
A variável mais simples é o tempo de molho, e o controle será um produto sem enzimas, se possível, do mesmo fabricante. Este pode ser substituído pelo produto com enzimas fervido durante 1 hora. Um cuidado prático importante é completar o volume de água evaporada ao ferver, de modo que as concentrações dos produtos sejam iguais.
Exemplo:
Realizamos a experiência com amostras manchadas com molho de tomate, deixadas de molho durante 2 ou 24 horas. Obtiveram-se os resultados da tabela abaixo, fotografados na figura que a segue. Nas condições do experimento, o aumento do tempo de molho melhorou ligeiramente o desempenho de ambos os produtos.
Tabela: Intensidade das manchas de molho de tomate nos panos deixados de molho com diferentes produtos (sem e com enzimas) durante tempos variáveis (2 horas, 24 horas). A imagem mostra os resultados do experimento.
COMO MONTAR UM PROJETO
Dos outros fatores que incidem no desempenho de um produto, talvez os mais interessantes sejam a temperatura e a concentração do produto. A partir deste protocolo é possível elaborar outros projetos de investigação.
Para aumentar a eficiência de um produto, podem-se trabalhar diferentes variáveis dentro de certos limites:
- Concentração: uma a quatro colheres das de sopa por litro, equivalente a 0,5% - 2% m/v. Como este valor é bem mais alto que o recomendado pelos fabricantes para as máquinas de lavar, o excesso de pó pode depositar e manchar as amostras. Para evitar este inconveniente, convém deixar decantar a solução e usar o sobrenadante.
- Duração do experimento: entre 2 e 24 horas.
- Temperatura: ambiente. Embora seja interessante, é difícil trabalhar com temperaturas diferentes sem instalações adequadas.
- Agitação: em geral, 10-20 vezes ao iniciar e 10-20 vezes ao terminar o tempo de incubação.
- Enxague: a melhor maneira é sem esfregar; enche-se e esvazia-se o recipiente 20 vezes até eliminar totalmente o produto. É preferível não pegar as amostras com a mão até estarem bem enxaguadas, porque as enzimas podem causar alergias. No caso de enxaguar na água da torneira, será necessário usar luvas ou um saco plástico como proteção.
- Secagem: à sombra, porque o sol e as luzes fortes alteram os pigmentos, dando resultados falsos.
13. OBTENÇÃO DE UM BIOPOLÍMERO (CELULOSE BACTERIANA)
As bactérias Gram negativas da família Acetobacter se desenvolvem em condições aeróbias, sendo que a transformação de carboidratos como o etanol em ácido acético (fermentação acética) é o fundamento da produção de vinagres.
Acetobacter xylinum é uma bactéria do solo que pode ser isolada de frutas caídas no chão. Como parte do metabolismo da glicose, sintetiza subunidades de celulose que são liberadas no meio por extrusão através dos poros da parede celular. A união dessas microfibrilas forma uma película que retém as bactérias formando um biofilme sobre o substrato em decomposição.
Do ponto de vista metabólico, a celulose é um metabólito secundário sintetizado quando as condições do meio são satisfatórias do ponto de vista nutritivo. Diversas pesquisas indicam que em Acetobacter xylinum, a síntese de celulose estaria controlada por um óperon.
A celulose é o polímero mais abundante em nosso planeta. Além de ser um dos principais constituintes da parede celular das plantas, a celulose tem numerosas aplicações industriais (vestimenta, papel). A celulose de origem bacteriana também encontra várias aplicações na indústria, como componente de membranas para headphones e como espessante de alimentos e tintas. Uma vez purificada e esterilizada, também tem sido utilizada para proteger ferimentos (queimaduras) antes de um transplante de pele.
OBJETIVO
Obter folhas de celulose a partir de uma cultura de Acetobacter xylinum.
MATERIAIS
Vinagre forte (6-8% de acidez) preparado como indicado anteriormente, 1 saquinho de chá (1 g), 2 colheres de açúcar, recipientes adequados, pano de algodão e elástico, filme de PVA (Rolopac ou similar).
PROCEDIMENTO
1. Preparar uma infusão com um 1 g de chá em 500 ml de água fervida.
2. Dissolver bem 2 colheres das de sopa de açúcar.
3. Deixar esfriar até a temperatura ambiente (30 graus Celsius é a temperatura ideal).
4. Acrescentar 50 ml de vinagre forte.
5. Distribuir em recipientes de vidro ou de plástico, enchendo-os até a metade.
6. Fechar cada recipiente com 1 pano de algodão, ajustado com um elástico. Incubar na escuridão.
7. Aguardar pelo menos de 7 a 10 dias para observar o crescimento de uma camada viscosa na superfície.
8. Retirar a camada viscosa da superfície, lavar e deixar secar sobre uma superfície de isopor, para que não grude.
NOSSO COMENTÁRIO
Esta atividade representa um desdobramento das atividades relacionadas com a produção de vinagre. No vinagre forte, coexistem diferentes espécies da família Acetobacter. Vinhos suaves favorecem o crescimento de A. xylinum e, portanto, da camada gelatinosa. Vinhos secos favorecem o crescimento de A. aceti, formando-se uma camada gelatinosa menor.
Neste caso, o vinho é substituído por uma infusão de chá açucarada, que fornece os nutrientes necessários ao microrganismo. A camada gelatinosa pode demandar vários lavados para retirar o açúcar remanescente. Se a manipulação for cuidadosa podem se obter folhas de celulose de tamanho A4, como as da figura ao lado.
COMO MONTAR UM PROJETO
- Experimentar com diferentes chás e com um meio de cultura definido.
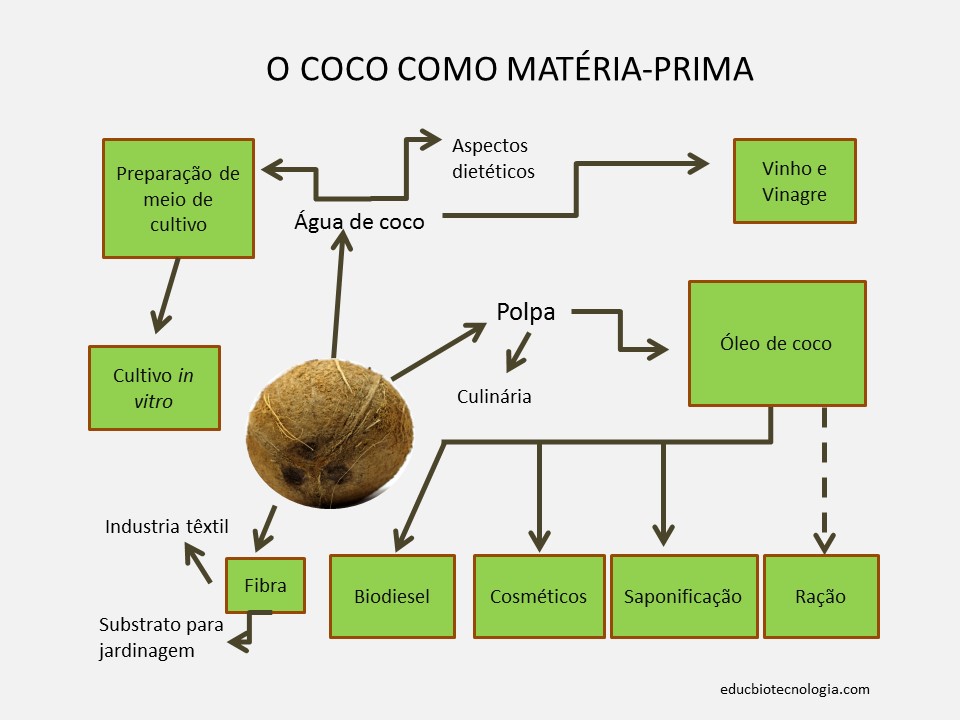
- Experimentar com água de coco. Nas Filipinas existe uma sobremesa, denominada nata de coco, preparada de maneira análoga.
- Testar o procedimento com diferentes tipos de açúcar (açúcar mascavo e açúcar cristal).
- Testar o procedimento com diferentes quantidades de açúcar (0 g, 40 g e 60 g).
MEIO LÍQUIDO DEFINIDO PARA O CULTIVO DE Acetobacter xylinum
Glicose 20 g
Extrato de levedura 5 g
Peptona 5 g
Fosfato de sódio dibásico 2,7 g
Ácido cítrico 1,15 g
Água destilada 1.000 ml
pH: 6,6-6,8
BIBLIOGRAFIA
CANNON, R et al. Acetobacter xylinum: an inquiry into cellulose biosynthesis. The American Biology Teacher 62:6, 2000.
A transformação de um polímero de origem biológica em bioplástico ocorre quando se altera sua estrutura com alguma substância dispersante. Nesta atividade, o óleo vegetal cumpre a função de agente dispersante do amido (polissacarídeo).
PRIMEIRA PARTE: BIOPLÁSTICOS RÍGIDOS DE AMIDO
OBJETIVO
Preparar um bioplástico a partir de amido e óleo vegetal.
MATERIAIS
Maisena, água, óleo vegetal, corante alimentar, sacos plásticos, forno de micro-ondas.
Medidas: 1 colher das de sopa de maisena = 8 g; 1 colher das de sopa de água = 15 mi
PROCEDIMENTO
1. Misturar em um saco plástico 2 colheres das de sopa de amido, 2 colheres das de sopa de água e umas gotas de corante para alimentos.
2. Acrescentar 4 ou 5 gotas de óleo vegetal no saco plástico e misturar muito bem o conteúdo.
3. Fechar o saco deixando uma abertura na ponta.
4. Esquentar no micro-ondas por 30 ou 40 segundos.
5. Aguardar até a temperatura abaixar e distribuir em formas.
6. Deixar secar a temperatura ambiente.
7. Repetir o procedimento anterior substituindo, no item 2, o óleo vegetal por água (Controle).
8. Analisar algumas das características do bioplástico obtido (dureza, flexibilidade, degradabilidade, por exemplo).
NOSSO COMENTÁRIO
Trata-se de uma atividade muito simples que sempre tem sucesso (ver a figura abaixo). Na hora de retirar o saco plástico do forno micro-ondas devem-se extremar os cuidados para evitar queimaduras. À medida que o plástico vai secando, perde a flexibilidade e, depois de um ou dois dias, fica rígido.
Figura 1: Diferentes momentos da preparação do bioplástico: o saco plástico antes de entrar no forno de micro-ondas; o mesmo saco plástico, depois do 30 segundos no forno de micro-ondas; o plástico umas horas depois, ainda conservando flexibilidade
COMO MONTAR UM PROJETO
- Comparar os bioplásticos obtidos com diferentes fontes: maisena, farinha de trigo, fécula de batata, fécula de mandioca etc.
- Comparar os bioplásticos obtidos com diferentes dispersantes: óleo de soja, óleo de girassol, óleo de milho etc.
- Modificar as proporções de maisena e óleo.
SEGUNDA PARTE: BIOPLÁSTICOS FLEXÍVEIS DE AMIDO
A denominação de biopolímeros abrange dois tipos de moléculas. O primeiro inclui as que são sintetizadas pelos seres vivos, como a celulose, o amido e os óleos vegetais, o segundo, as que resultam da polimerização de uma molécula básica proveniente de uma fonte renovável, como o ácido láctico. A alteração da estrutura de um biopolímero mediante um agente dispersante o transforma em um bioplástico.
Plásticos flexíveis podem ser preparados a partir de um biopolímero como o amido, utilizando o glicerol como agente plastificante. O amido é hidrolisado parcialmente, em meio ácido e temperatura alta. O glicerol aumenta o volume livre entre as cadeias de amilose e amilopectina liberadas, diminuindo as interações entre ambas e favorecendo o movimento de uma em relação à outra.
OBJETIVO
Preparar bioplásticos flexíveirs de amido.
MATERIAIS
Estufa, banho-maria a 100 graus Celsius, agitador magnético (eventualmente), 5g de amido de milho (ou de batata), 40 ml de água destilada, HCl 0,1 M, NaOH 0,1 M, glicerina comercial, corante alimentar, uma bandeja de isopor de aproximadamente 20 x 14 cm.
PROCEDIMENTO
1. Colocar em um béquer 5 g de amido de milho. Acrescentar, misturando bem, 40 ml de água destilada, 4 ml de glicerina 50% (v/v), 6 ml de HCl 0,1 M e umas gotas de corante alimentar.
2. Manter aproximadamente 10 minutos no banho-maria fervente, agitando continuamente, até a mistura ficar viscosa. Adicionar de 2 a 8 ml de NaOH 0,1 M, para diminuir a viscosidade.
3. Verter a mistura em uma bandeja de isopor, do tipo das utilizadas no comércio para acondicionar gêneros alimentícios.
4. Secar na estufa.
RESULTADOS
Analisar as características do bioplástico obtido (Dissolução em água, biodegradabilidade, resistência, flexibilidade, combustibilidade).
NOSSO COMENTÁRIO
Do ponto de vista técnico, vale a pena destacar que a secagem na estufa pode ser substituída pela secagem ao sol e que os melhores moldes são as bandejas de isopor utilizadas no comércio para acondicionar alimentos.
Comprovamos, também, que tanto as folhas para separar alimentos como o filme de PVC permitem guardar os bioplásticos obtidos sem que as peças grudem umas nas outras.
COMO MONTAR UM PROJETO
- Elaborar bioplásticos, adaptando o roteiro para amidos de diferente origem (batata inglesa, mandioca).
- Comparar as propriedades dos bioplásticos obtidos com diferentes matérias-primas.
- Investigar como adaptar o roteiro para obter um bioplástico aceitável a partir de amido de batata ou de mandioca.
A transformação de um polímero de origem biológica em bioplástico ocorre quando se altera sua estrutura com alguma substância dispersante. Nesta atividade, a glicerina cumpre a função de agente dispersante da gelatina (proteína).
OBJETIVO
Preparar um bioplástico a partir de gelatina e glicerina.
MATERIAIS
Um pacote de gelatina branca comercial (12 g), glicerina comercial, tubos de ensaio, béqueres, pipetas, espátula, baqueta, água, moldes, balança, forno de microondas.
PROCEDIMENTO
1. Preparar 10 ml de uma solução de glicerina 1:20 (0,5 ml de glicerina + 9,5 ml de água)
2. Preparar 10 ml de uma solução de glicerina 1:5 (2 ml de glicerina + 8 ml de água).
3. Distribuir 4 g de gelatina em cada béquer e acrescentar em cada um 10 ml de água.
4. Colocar os 3 béqueres no forno de microondas (potencia alta, 15 segundos) para dissolver a gelatina. Misturar bem.
5. Acrescentar 10 ml de água no primeiro béquer, 10 ml da solução de glicerina 1:20 no segundo e 10 ml da solução de glicerina 1:5 no terceiro.
6. Esquentar novamente o conteúdo dos 3 béqueres no forno de microondas (potencia média, 45 segundos). Misturar bem e distribuir nos moldes.
7. Deixar secar na estufa (40 graus Celsius).
8. Analisar as características dos bioplásticos obtidos, em relação ao controle.
Figura: Flexibilidade de bioplásticos de gelatina obtidos com diferente concentração do agente dispersante (glicerina).
À medida que a concentração do agente dispersante aumenta, os plásticos ganham flexibilidade (figura).
Em concentrações superiores, obtivemos plásticos pegajosos, com uma consistência parecida à borracha. Folhas para separar alimentos ou filme de PVC permitem conservar os plásticos sem que grudem entre si.
A gelatina branca pode ser substituída por gelatina colorida sem sabor. Também podem ser acrescentadas umas gotas de corante de alimentos. As gelatinas diet são interessantes pelo colorido, mas dão produtos muito mais flexíveis e não sabemos se é porque estão em menor concentração, ou porque levam muitos aditivos.
O tema foi desenvolvido por Gabriel Politzer Couto e Guilherme Fagundes Pagotto, alunos do Curso Técnico Nível Médio de Biotecnologia (2010).
COMO MONTAR UM PROJETO
- Comparar os bioplásticos obtidos com diferentes concentrações de glicerina.
- Comparar os bioplásticos obtidos substituindo a gelatina por caseína, que é outra proteína.
16. PLÁSTICOS E DERIVADOS DE CASEÍNA
A caseína é a principal proteína do leite, e está presente nele como um sal de cálcio solúvel (3%m/v). Precipita com a adição de ácidos, o que possibilita sua extração. Na indústria, esse processo é realizado com ácido clorídrico ou sulfúrico, ou com uma enzima (renina). A caseína é a matéria-prima da fabricação de alimentos (queijos), colas, tintas e materiais plásticos (galalite).
COLAS
Até o início deste século, as principais matérias-primas utilizadas como cola eram de origem biológica, tais como o sangue de alguns animais ou as resinas naturais extraídas de folhas e troncos de algumas árvores. Atualmente, temos uma grande variedade de colas produzidas industrialmente, a partir de substâncias sintéticas, com a finalidade de se adaptar aos novos materiais (polímeros, cerâmicas especiais e ligas metálicas modernas).
Contudo, as colas naturais ainda são recomendadas para algumas aplicações domésticas, como a adesão de papéis ou peças de madeira na construção de pequenos objetos. Além de fácil de preparar, a cola de caseína apresenta um poder de adesão considerável. Na Primeira Guerra Mundial era utilizada na construção de aviões, cuja estrutura era composta, quase exclusivamente, por peças de madeira.
TINTAS
Muitas tintas comerciais são compostas por uma suspensão de pigmentos coloridos em uma substância que permite espalhá-los em um papel ou uma tela. Neste caso o veículo é a caseína.
PLÁSTICOS
Os plásticos de caseína (galalite) foram exibidos pela primeira vez na exposição de Paris de 1900 e durante anos foram utilizados na confecção de botões, joias e canetas. Apesar de ter-se procurado alternativas à passagem pelo formol, que é tóxico, as tentativas de modernização do processo produtivo fracassaram. A galalite deixou de ser produzida comercialmente em 1980.
OBJETIVO: Preparar cola, tintas e um plástico a partir de um biopolímero, a caseína.
MATERIAIS
Leite desnatado, vinagre ou limão, filtro de pano, bicarbonato de sódio, mertiolate, corantes de alimentos, tampas de refrigerante (moldes), formol, material básico de laboratório.
Cuidado! O formol é tóxico
PROCEDIMENTOS
Extração de caseína
1. Esquentar 100 ml de leite desnatado a 50 graus Celsius.
2. Acrescentar lentamente vinagre ou limão, até o leite talhar.
3. Filtrar, para separar a caseína.
4. Lavar a caseína para retirar todo o soro e filtrar novamente.
Preparação de uma cola
1. Adicionar 1 g de bicarbonato de sódio à caseína.
2. Acrescentar aos poucos 10 a 15 ml de água até obter a consistência adequada.
3. Colocar uma ou duas gotas de mertiolate como conservante.
4. Fazer os testes correspondentes.
Preparação de tintas
1. Acrescentar água a uma quantidade de caseína equivalente a uma moeda até obter uma massa espessa.
2. Colocar umas gotas de algum corante de alimentos e misturar bem.
3. Fazer os testes correspondentes.
Obtenção de um bioplástico (Galalite)
1. Comprimir bem a caseína e dar-lhe alguma forma como, por exemplo, um dado, uma esfera, um disco etc.
2. Mergulhar o material em formol 30-40% (cuidado, é tóxico!) e deixar em repouso pelo menos uma semana.
Lavar bem e deixar secar ao ar.
3. Analisar as características do bioplástico obtido (Dissolução em água, biodegradabilidade, resistência, combustibilidade).
NOSSO COMENTÁRIO
Trata-se de uma atividade clássica, sem grandes complicações. Altamente motivadora, mostra algumas aplicações de um biopolímero na indústria. As figuras 1, 2 e 3 mostram os primeiros testes realizados por alunos para uma apresentação na SNCT (2005). Devido a considerações de segurança, os sais inorgânicos tradicionalmente utilizados foram substituídos por corantes de alimentos.
O formol deve ser manipulado pelo professor, preferentemente na capela de exaustão do laboratório de Química.
O tema foi desenvolvido na SNCT de 2006 pelos alunos do Nono ano do Ensino Fundamental II do Instituto de Tecnologia ORT.
Figura 1: Cola de caseína. Preparação da cola e utilização da cola com papeis.
Figura 3: Discos de galalite
Os detergentes são substâncias utilizadas na limpeza de objetos. Trata-se de compostos formados por moléculas complexas, com longas cadeias de carbono, que acomodam na sua estrutura duas extremidades: uma polar, que faz com que eles sejam solúveis em água, e outra apolar, que permite que eles solubilizem a gordura.
A liberação de detergentes de uso doméstico ou industrial no ambiente pode ser uma fonte de poluição considerável. Por isso é importante que eles sejam biodegradáveis, ou seja que sua estrutura possa ser decomposta pela ação de bactérias. Nesta atividade, acompanharemos a biodegradação de um detergente por bactérias do meio ambiente.
MATERIAL
2 garrafões, 3 tubos de ensaio para cada grupo de alunos, régua, detergente em pó, meio nutriente, solo fresco, 2 bombas de aquário, conexões plásticas, 2 pedras porosas.
Anotar os dados na tabela

RESULTADOS
As medições indicam a quantidade (mL) de espuma formada pelo detergente ao longo da biodegradação deste por agentes bacterianos.
Represente graficamente (diagrama de barras) a quantidade de espuma (média e desvio padrão de 3 medidas) nas garrafas A e B no início e no fim da experiência.
Com base nos dados levantados oportunamente e levando em conta o aspecto de cada garrafão, interprete o que aconteceu.
NOSSO COMENTÀRIO
Utilizamos uns miniagitadores elétricos vendidos no comércio para fazer espuma no capuccino
A agitação deve ser padronizada previamente tanto na intensidade como na duração. Antes de medir convém aguardar 5 minutos porque a espuma diminui de maneira exponencial e os valores passado esse intervalo são mais estáveis. O erro (desvio padrão) é menor.
Detergentes biodegradáveis estão formados por cadeias lineares de carbono. Os detergentes de cadeia ramificada, que não podem ser biodegradados, formam camadas gigantescas de espuma quando lançados em rios, sufocando a vida nas águas. Hoje, eles estão proibidos.
18. BIODEGRADAÇÃO DE ÓLEOS E GORDURAS
Os óleos e gorduras pertencem a um grupo de lipídios, denominados glicerídeos. A molécula de glicerídeo se forma mediante a união de um álcool chamado glicerol com três moléculas de ácidos graxos. Os glicerídeos de origem animal são geralmente sólidos, como a manteiga e a banha das carnes. Já os glicerídeos de origem vegetal são quase sempre líquidos, como os do óleo de soja, de milho, de oliva ou de girassol. As margarinas são obtidas a partir de óleos vegetais solidificados artificialmente (hidrogenação).
Exoenzimas bacterianas (lípases) hidrolisam as moléculas dos lipídios em glicerol e ácidos graxos que dão um flavor ranço e aroma característico. Algumas bactérias fermentam o glicerol, outras oxidam os ácidos graxos.
Os sistemas de esgotos têm grande dificuldade em decompor os lipídios porque o processo é lento e requer uma grande quantidade de oxigênio. Cultivos bacterianos são utilizados para degradar a gordura dos efluentes de restaurantes e indústrias processadoras de carne.
MATERIAL
Garrafas, óleo, água, uma suspensão bacteriana (Gorduraklin, por exemplo), papel pardo, uma vareta de vidro fina.
PROCEDIMENTO
RESULTADOS
Comparar as médias dos diâmetros das manchas.
NOSSO COMENTÁRIO
É uma atividade que requer paciência e cuidado.

Outra forma de selecionar essas bactérias é em meio mínimo de ágar-óleo. O óleo (proporção 1%) se acrescenta ao meio e se agita a velocidade alta durante 5 minutos antes de transferir a um recipiente adequado e proceder à esterilização.
BIBLIOGRAFIA
CHRISTINE CASE Biodegradation of Oils.
19. TRIAGEM DE BACTÉRIAS DEGRADADORAS DE GASOLINA
A triagem se realiza em um meio sólido contendo exclusivamente sais minerais de maneira que a única fonte de carbono seja a gasolina. A degradação desta fornece carbono e energia a vários tipos de bactérias, possibilitando o seu crescimento.
OBJETIVO: Selecionar bactérias capazes de degradar gasolina
A triagem se realiza em um meio sólido contendo exclusivamente sais minerais de maneira que a única fonte de carbono seja a gasolina. A degradação desta fornece carbono e energia a vários tipos de bactérias, possibilitando o seu crescimento.
MATERIAIS
2 placas de Petri A e B com meio mínimo (sais minerais) e agar (1,5%) ou agar preparado na mesma concentração com água e 1-2 gotas de fertilizante contendo nitrogênio e fósforo; gasolina (# 10 mL); solo misturado com alguns mL de água; cotonete estéril ou alça de Drigalsky.
PROCEDIMENTO
1. Em cada placa, distribuir 0,5 mL de solo no agar com a alça de Drigalsky ou com o cotonete esterilizado.
2. Na tampa da Placa de Petri A colocar uma folha de papel de filtro embebida em gasolina.
3. Na tampa da Placa de Petri B colocar uma folha de papel de filtro embebida em água (controle).
4. Selar a placa para evitar a evaporação da gasolina.
5. Incubar a 30 graus Celsius, até observar o aparecimento de colônias
NOSSO COMENTÁRIO
A probabilidade de selecionar essas bactérias é maior se a amostra é coletada em um posto de venda de gasolina. Pode-se verificar a eficiência das colônias obtidas em degradar gasolina, cultivando-as em meio mínimo líquido com diferentes concentrações do combustível.
O controle permite diferenciar, eventualmente, as bactérias degradadoras de gasolina de bactérias degradadoras de ágar.
O coco é o fruto de Cocus nucifera (família Arecaceae), uma árvore originária da Ásia. Como matéria-prima para diversas industrias (alimentos, cosmética, têxtil), o coco cumpre um importante papel socioeconômico.
A polpa do coco seco ou copra contém mais de 60% de óleo que pode ser extraído por diversos métodos. Além de rico em ácido láurico, o óleo de copra não sofre degradação a altas temperaturas.
OBJETIVO
Extrair e caracterizar o óleo de copra (polpa do coco).
MATERIAIS
Coco seco, béquer de vidro, forno de micro-ondas, faca de bom corte, liquidificador, funil, garrafa plástica, balão e elástico, tesoura, coador, bacia.
O uso de um forno de micro-ondas para separar o óleo da polpa é recomendado porque não se desprende fumaça. Não se deve utilizar material de polipropileno porque derrete. Preferir material de vidro ou material apropriado para micro-ondas.
PROCEDIMENTO
Extração do óleo
1. Furar os “olhos” do fruto para retirar a água.
2. Abrir os cocos.
3. Retirar e picar a polpa em pequenos pedaços.
4. Bater a polpa com a água do próprio coco no liquidificador até que se forme uma pasta.
5. Espremer esta pasta em uma bacia, separando a massa do leite de coco.
6. Com um funil, transferir o leite de coco para uma garrafa plástica e deixar em local escuro por cerca de 48 horas (Fermentação).
7. Colocar a garrafa na geladeira, onde o óleo de coco e a polpa formarão uma camada sólida na parte superior.
8. Com uma tesoura, abrir a garrafa e retirar a mistura sólida de óleo e polpa.
9. Aquecer no micro-ondas até o óleo ficar liquido, “fritando” a parte da polpa que sobrou.
10. Coar o óleo, separando-o da polpa.
11. Conservar ambos os produtos na geladeira.
12. Calcular o rendimento (V/m% e m/m%) do procedimento. Observação: De três extrações realizadas, o melhor rendimento (m/m%) foi o último, no valor de 17,6%.
13. Determinar o ponto de fusão do óleo extraído. Observação: A figura ao lado mostra a montagem utilizada para medir o ponto de fusão do óleo extraído (PF: 22 graus Celsius)
NOSSO COMENTÁRIO
A extração do óleo de copra foi uma das atividades desenvolvidas com sucesso por Allan Schechter, Ingrid Amaral e Pedro Thiengo no trabalho de finalização do Curso Médio Técnico de Biotecnologia, titulado “O coco (Cocus nucifera) como matéria-prima”. As imagens acima ilustram várias etapas do trabalho realizado.
COMO MONTAR UM PROJETO
Modificar a técnica de modo a melhorar o rendimento da extração.
Um trabalho que permite vivenciar o conceito de biorrefineria, a partir de um material do dia-a-dia.
23. OS RIZÓBIOS E AS LEGUMINOSAS
Uma das relações entre plantas e microrganismos que trazem benefícios para agricultura ocorre entre as bactérias fixadoras de nitrogênio e as plantas leguminosas (feijão, soja, etc.).
OBJETIVO: visualizar os nódulos de bactérias fixadoras de nitrogênio (rizobios) nas raízes de soja.
MATERIAIS
2 vasos para plantas, sementes de soja, terra de jardim, areia, copos plásticos, água, solução de inoculante com bactérias fixadoras de nitrogênio (Bradirhizobium japonicum ou Rhizobium leguminosarum bv.Phaseoli), estufa, balança.
PROCEDIMENTO
Colocar de molho 10 sementes de soja, com 24 a 48 horas de antecedência.
1. Misturar a terra com areia (proporção 2:1).
2. Distribuir a mistura em dois vasos.
3. Em um dos vasos, introduzir 5 sementes na terra, a uma profundidade equivalente a 3 vezes o tamanho da semente.
4. Preparar a solução de rizobios, na proporção indicada pelo fornecedor.
5. Mergulhar 5 sementes na solução anterior e deixar alguns minutos, antes de proceder à semeadura como no item 3.
6. Molhar as plantas a cada dois dias, até elas atingirem o tamanho que torna necessário que sejam molhadas diariamente.
7. Acompanhar o crescimento das plantas registrando a quantidade de sementes germinadas, o tamanho do caule, o número de folhas, a aparição e queda dos cotilédones, a formação das flores e das vagens e, finalmente, a massa seca.
8. Observar os nódulos nas raízes das plantas.
9. Comparar o desenvolvimento das plantas inoculadas e das plantas não inoculadas (controle).
NOSSO COMENTÁRIO
Esta atividade demora vários meses e requer uma boa dose de paciência e dedicação, mas o resultado compensa. Em outra ocasião um grupo de alunos tentou cultivar as sementes inoculadas em um médio com ágar-água. Apesar de ser um experimento bem mais caro, os resultados foram interessantes e figuram na foto ao lado.
As fotos abaixo mostram algumas das etapas do trabalho de finalização do curso Técnico de Biotecnologia (Nível Médio), realizado por Clarissa Araujo Costa Naveira e Silva, Ilana Cytryn dos Reis e Nathalia Araujo Costa Naveira e Silva.
Outra possibilidade é o cultivo em ágar. Embora as plantas não cresçam tão bem, os nódulos são bem vissíveis.
Figura 1: À esquerda, rizóbios em raíz de soja cultivada em terra (x20); à direita raíz de soja cultivada em agar